题目内容
6.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g•L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为Si3N4;丙的电子式为
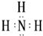 .
.(2)甲与NaOH浓溶液共热的化学方程式为AlN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaAlO2+NH3↑.
(3)丁溶液中通入少量CO2的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为Fe2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2Fe+N2+3H2O,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成.
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
分析 甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成,甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g•L-1,其摩尔质量=0.76g/L×22.4L/mol=17g/mol,为NH3,则甲为铵盐、丁为钠盐;
在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,且丁是钠盐,应该为NaAlO2;
Z元素的氧化物是制造光导纤维的主要材料,为Si元素;
根据元素守恒知,甲中含有Al元素和N元素,则甲为AlN,X为N元素、Y为Al元素,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Si单质恰好反应制得乙,n(Si)=$\frac{4.2g}{28g/mol}$=0.15mol,则乙化学式为Si3N4,
结合题目分析解答.
解答 解:甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成,甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g•L-1,其摩尔质量=0.76g/L×22.4L/mol=17g/mol,为NH3,则甲为铵盐、丁为钠盐;
在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,且丁是钠盐,应该为NaAlO2;
Z元素的氧化物是制造光导纤维的主要材料,为Si元素;
根据元素守恒知,甲中含有Al元素和N元素,则甲为AlN,X为N元素、Y为Al元素,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Si单质恰好反应制得乙,n(Si)=$\frac{4.2g}{28g/mol}$=0.15mol,则乙化学式为Si3N4,
(1)通过以上分析知,乙为Si3N4,丙是氨气,氨气分子中每个H原子核N原子形成一个共用电子对,其电子式为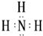 ,
,
故答案为:Si3N4;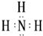 ;
;
(2)甲是AlN,与NaOH溶液反应方程式为AlN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaAlO2+NH3↑;
(3)丁是偏铝酸钠,和二氧化碳反应生成氢氧化铝沉淀和碳酸钠,离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)丙是氨气,高温条件下,丙与Fe2O3反应生成Fe和X单质,根据反应条件、反应物和生成物知,反应方程式为Fe2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2Fe+N2+3H2O,FeO和硫酸铜发生置换反应生成Fe,Fe和稀盐酸反应生成亚铁离子,亚铁离子能被氯水氧化生成铁离子,用KSCN溶液检验铁离子,其检验方法为取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成,
故答案为:Fe2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2Fe+N2+3H2O;取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(5)在氮气的气氛下将Z的氧化物SiO2和焦炭加热到1400℃~1450℃的条件下以制备Si3N4,反应中还生成一种常见的可燃性气体戊为CO,反应方程式为3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,
故答案为:3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析判断能力及知识综合运用能力,明确物质性质及物质之间转化是解本题关键,知道铁离子、亚铁离子检验方法及实验现象,题目难度中等.

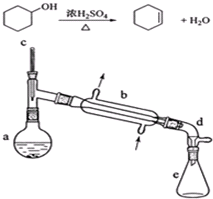
可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为
 .
. | A. | 盐酸与氨水混合:H++OH-═H2O | |
| B. | 金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠与过量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气与碘化钾溶液的反应:Cl2+I-=I2+Cl- |
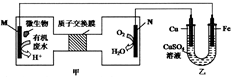 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
| A. | 二 | B. | 一 | C. | 四 | D. | 三 |
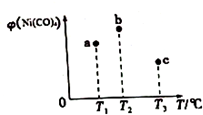 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
 .
.