题目内容
15.在实验室里,要想使氯化铝溶液中的铝离子全部沉下来,应选用( )| A. | 石灰水 | B. | 氢氧化钠溶液 | C. | 硫酸 | D. | 氨水 |
分析 若使Al3+全部生成氢氧化铝沉淀,可以和碱反应,也可以和水解显碱性的盐反应;
Al(OH)3是两性氢氧化物能溶于强酸和强碱,Al3+离子全部沉淀需要所加的试剂过量,所以全部沉淀Al3+一般选择用弱碱,如氨水溶液.
解答 解:A、石灰水是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,所以Al3+不能全部沉淀出来,故A错误;
B、氢氧化钠溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,所以Al3+不能全部沉淀出来,故C错误;
C、硫酸不能和氯化铝反应生成氢氧化铝,故C错误;
D、氨水是弱碱溶液,可以加入过量氨水,全部沉淀Al3+,且Al(OH)3不溶于弱碱氨水溶液,故D正确;
故选D.
点评 本题考查了铝盐、氢氧化铝的性质应用,重点考查氢氧化铝的实验室制备,注意氢氧化铝是两性强氧化物,本题难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
5.硫酸锰可用于饲料营养强氧化剂和媒染剂.其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺如图1:
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )
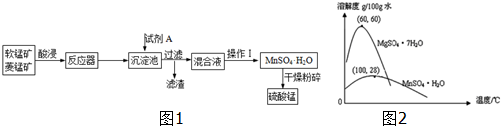
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )

| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molH2O含有的H2O分子数为NA | |
| B. | 1mol金属镁与足量的盐酸完全反应,转移的电子数为2NA | |
| C. | 11.2L氧气含有的O2分子数为0.5NA | |
| D. | 将含1molFeCl3的溶液与沸水完全反应,生成的Fe(OH)3胶体粒子数为NA |
3.漂白粉的主要成分是( )
| A. | 次氯酸钙 | B. | 氯化钙 | ||
| C. | 次氯酸 | D. | 次氯酸钙与氯化钙 |
10.在标准状况下进行甲、乙、丙三组实验.三组实验均各取30mL同浓度的盐酸,加入同一种镁铝混合物粉末,产生气体,有关数据见下表:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?为什么?乙,因甲反应后的溶液中再加入合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应,生成336mL氢气需要金属的质量为0.255g×$\frac{336mL}{280mL}$=0.306g,故乙中金属剩余
(2)盐酸的物质的量浓度为1mol/L.
(3)Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)盐酸的物质的量浓度为1mol/L.
(3)Mg、Al物质的量之比为1:1.
20.下列关于金属氧化物的说法中正确的是( )
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
7.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”.这主要是由于硅及其化合物对社会发展所起的巨大促进作用.下列关于硅及其化合物的说法中错误的是( )
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
4.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |