题目内容
11.由铜、锌和稀硫酸组成的原电池中:锌是负极,发生氧化(“氧化”或“还原”)反应,电极反应式是Zn-2e-=Zn2+;铜是正极,电极反应式是2H++2e-=H2↑.分析 原电池形成条件是活泼性不同的两个电极,电解质溶液,闭合回路,自发进行的氧化还原反应,原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是正极,电子流向从负极盐导线流向正极,根据得失电子判断电极名称.
解答 解:由铜、锌和稀硫酸组成的原电池中,锌做负极失电子发生氧化反应,电极反应为Zn-2e-=Zn2+;铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑,铜极表面产生气泡,
故答案为:负;氧化;Zn-2e-=Zn2+;正,2H++2e-=H2↑.
点评 本题考查原电池的正负极的判断及电极反应式,注意根据氧化还原反应得失电子判断原电池的正负极,题目较简单.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
9.气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
2.硒是生命元素之一.从含硒废料中回收硒的工艺流程如下:
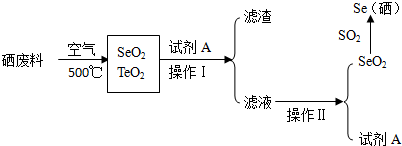
已知如下信息:
Ⅰ.硒废料中含硒约97%,其余为碲和微量的氯.
Ⅱ.灼烧过程中,硒、碲分别转化成SeO2、TeO2.
Ⅲ.SeO2、TeO2的部分物理性质如下:
回答下列问题:
(1)硒和溴位于同周期,下列性质不能说明溴的非金属性比硒强的是A.(填代号)
A.沸点:Se>Br2 B.还原性:H2Se>HBr
C.酸性:H2SeO4<HBr O4 D.还原性:Se>Br2
(2)在周期表中硒和硫位于同主族且相邻,则硒和硫的原子序数相差18;硒在周期表中的位置是第四周期ⅥA族.
(3)在硒废料灼烧过程中,为了提高反应速率,宜采用的措施有粉碎废料、搅拌(写一条即可).
(4)上述流程中,可循环利用的物质是乙醇(CH3CH2OH);操作II的名称是蒸馏.
(5)写出SeO2和SO2反应的化学方程式并注明电子转移数目和方向: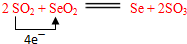 .
.

已知如下信息:
Ⅰ.硒废料中含硒约97%,其余为碲和微量的氯.
Ⅱ.灼烧过程中,硒、碲分别转化成SeO2、TeO2.
Ⅲ.SeO2、TeO2的部分物理性质如下:
 | 沸点/℃ | 溶解性 |
| SeO2 | 684 | 易溶于水和乙醇 |
| TeO2 | 1260 | 微溶于水,不溶于乙醇 |
(1)硒和溴位于同周期,下列性质不能说明溴的非金属性比硒强的是A.(填代号)
A.沸点:Se>Br2 B.还原性:H2Se>HBr
C.酸性:H2SeO4<HBr O4 D.还原性:Se>Br2
(2)在周期表中硒和硫位于同主族且相邻,则硒和硫的原子序数相差18;硒在周期表中的位置是第四周期ⅥA族.
(3)在硒废料灼烧过程中,为了提高反应速率,宜采用的措施有粉碎废料、搅拌(写一条即可).
(4)上述流程中,可循环利用的物质是乙醇(CH3CH2OH);操作II的名称是蒸馏.
(5)写出SeO2和SO2反应的化学方程式并注明电子转移数目和方向:
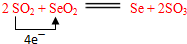 .
.
19.核外电子是分层排布的,原子核外有K、L、M、N、O、P、Q等电子层,K电子层和L电子层最多容纳的电子数的关系是( )
| A. | K层多 | B. | L层多 | C. | 相等 | D. | 不能确定 |
6.下列说法错误的是( )
| A. | 原子半径:Li<Na<K | B. | 稳定性:PH3>H2S>HCl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
16.下列气体中,不能用浓硫酸作干燥剂的是( )
①HCl; ②NH3; ③Cl2; ④H2; ⑤H2S; ⑥SO2.
①HCl; ②NH3; ③Cl2; ④H2; ⑤H2S; ⑥SO2.
| A. | ②④⑤⑥ | B. | ①②⑤ | C. | ②⑤ | D. | ①②④⑤ |
3.检验Na2SO3 是否变质所用的试剂是( )
| A. | BaCl2、HCl | B. | Ba(NO3)2、HNO3 | C. | Ba(NO3)2、HCl | D. | BaCl2、H2SO4 |
1.某主族元素R的最高价氧化物对应的水化物的分子式是H2RO4,该元素在周期表中位于( )
| A. | IVA族 | B. | VA族 | C. | VIA族 | D. | VIIA族 |
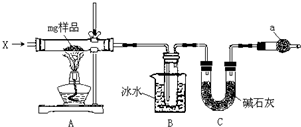 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:
为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下: