题目内容
2.硒是生命元素之一.从含硒废料中回收硒的工艺流程如下: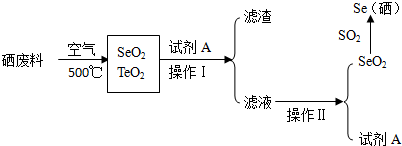
已知如下信息:
Ⅰ.硒废料中含硒约97%,其余为碲和微量的氯.
Ⅱ.灼烧过程中,硒、碲分别转化成SeO2、TeO2.
Ⅲ.SeO2、TeO2的部分物理性质如下:
 | 沸点/℃ | 溶解性 |
| SeO2 | 684 | 易溶于水和乙醇 |
| TeO2 | 1260 | 微溶于水,不溶于乙醇 |
(1)硒和溴位于同周期,下列性质不能说明溴的非金属性比硒强的是A.(填代号)
A.沸点:Se>Br2 B.还原性:H2Se>HBr
C.酸性:H2SeO4<HBr O4 D.还原性:Se>Br2
(2)在周期表中硒和硫位于同主族且相邻,则硒和硫的原子序数相差18;硒在周期表中的位置是第四周期ⅥA族.
(3)在硒废料灼烧过程中,为了提高反应速率,宜采用的措施有粉碎废料、搅拌(写一条即可).
(4)上述流程中,可循环利用的物质是乙醇(CH3CH2OH);操作II的名称是蒸馏.
(5)写出SeO2和SO2反应的化学方程式并注明电子转移数目和方向:
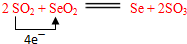 .
.
分析 硒废料中含硒约97%,其余为碲和微量的氯,灼烧过程中,硒、碲分别转化成SeO2、TeO2,SeO2易溶于水和乙醇,TeO2微溶于水,不溶于乙醇,加入试剂A为乙醇,操作Ⅰ为过滤,得到滤渣为TeO2,滤液为SeO2的乙醇溶液,通过蒸馏方法分离得到SeO2和试剂A,
(1)同周期非金属的非金属性强弱判断依据是单质的氧化性、最高价氧化物对应水化物形成酸的酸性、氢化物稳定性、氢化物还原性等,据此分析选项;
(2)周期表中硒和硫位于同主族且相邻,硫为16号元素,则硒为硫的原子序数+第四周期元素种数,原子核外电子层数为周期序数,最外层电子数为主族序数;
(3)增加反应速率的措施是升温、中等压强、增大浓度、加入催化剂、增大接触面积等;
(4)参与反应过程最后又生成的物质可以循环使用,分析可知操作Ⅱ为蒸馏Ⅱ乙醇和二氧化硒;
(5)SeO2和SO2反应发生的是氧化还原反应,二氧化硫被氧化为三氧化硫,二氧化硒被还原为硒单质;
解答 解:硒废料中含硒约97%,其余为碲和微量的氯,灼烧过程中,硒、碲分别转化成SeO2、TeO2,SeO2易溶于水和乙醇,TeO2微溶于水,不溶于乙醇,加入试剂A为乙醇,操作Ⅰ为过滤,得到滤渣为TeO2,滤液为SeO2的乙醇溶液,通过蒸馏方法分离得到SeO2,和试剂A,
(1)同周期非金属的非金属性强弱判断依据是单质的氧化性、最高价氧化物对应水化物形成酸的酸性、氢化物稳定性、氢化物还原性等,
A.沸点:Se>Br2 只能说明分子间作用力强,不能说明非金属性强弱,故A错误;
B.氢化物还原性越强,对应非金属性越弱,H2Se>HBr说明硒的非金属性弱,故B正确;
C.最高价氧化物对应水化物形成的酸的酸性越强,对应非金属性越强,H2SeO4<HBr O4 说明硒的非金属性弱,故C正确;
D.还原性:Se>Br2说明 失电子能力强,则溴的得电子能力强,单质氧化性Se<Br2,证明非金属性溴强,故D正确;
故答案为:A;
(2)周期表中硒和硫位于同主族且相邻,硫为16号元素,则硒为硫的原子序数+第四周期元素种数=16+18=34,硒和硫的原子序数相差18,原子核外电子层数为四层=周期序数,最外层电子数为6=主族序数,则硒元素位于 第四周期ⅥA族,
故答案为:18;第四周期ⅥA族;
(3)增加反应速率的措施是升温、中等压强、增大浓度、加入催化剂、增大接触面积等,在硒废料灼烧过程中,为了提高反应速率,宜采用的措施有粉碎废料、搅拌等,
故答案为:粉碎废料、搅拌;
(4)参与反应过程最后又生成的物质可以循环使用,上述流程中分析可知,可循环利用的物质是乙醇,操作Ⅱ是分离乙醇和二氧化硒的操作为蒸馏,故答案为:乙醇(CH3CH2OH);蒸馏;
(5)SeO2和SO2反应发生的是氧化还原反应,二氧化硫被氧化为三氧化硫,二氧化硒被还原为硒单质,硫元素化合价+4价变化为+6价,吸元素化合价+4价变化为0价,则SeO2和SO2反应和注明电子转移数目和方向的化学方程式为: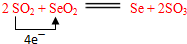
故答案为: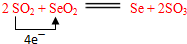 ;
;
点评 本题考查了物质分离提纯方法、实验基本操作、影响化学反应速率的因素、氧化还原反应电子转移等知识点,题目难度中等.

| A. | ①>②>③>④>⑤ | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ⑤>④>③>②>① |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,下列试剂中最适宜的试剂是B
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液.
| A. | 3Cu+8HNO3═3Cu(NO3)2+2NO↑十4H2O | B. | C+4HNO3═CO2↑+4NO2↑十2H2O | ||
| C. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | D. | NaOH+HNO3═Na NO3十H2O |
| A. | 硝酸钾 | B. | 硫黄 | C. | 木炭 | D. | 氯化钠 |
| A. | 甲醇 | B. | 1-丙醇 | ||
| C. | 2-甲基-2-丙醇 | D. | 2,2-二甲基-1-丙醇 |
| A. | 某试样焰色反应呈黄色,则试样中一定有钠盐 | |
| B. | 广泛pH试纸测得次氯酸溶液的pH为5 | |
| C. | 温度计不能当作玻璃棒使用 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |