题目内容
13.在KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O反应中,氧化剂与还原剂物质的量之比为( )| A. | 1:6 | B. | 6:1 | C. | 1:5 | D. | 1:1 |
分析 根据化合价的变化判断反应的氧化剂和还原剂,进而根据方程式结合得失电子守恒计算.
解答 解:反应KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O中,KClO3中Cl元素的化合价由+5→0,被还原,为氧化剂,
HCl中Cl元素化合价有-1→0,被氧化,为还原剂,其中6molHCl生成1molKCl,被氧化的HCl为5mol,
则氧化剂与还原剂物质的量之比为1:5,
故选C.
点评 本题考查氧化还原反应,题目难度不大,注意正确判断化合价的变化为解答该题的关键,侧重于考查学生的分析能力.

练习册系列答案
相关题目
1.以下区别二氧化硫和二氧化碳气体的最好方法是( )
| A. | 通入澄清石灰水 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用品红溶液 | D. | 根据气体有无颜色 |
8.下列方法能用来验证Fe3+的是( )
①溶液呈浅绿色 ②与碱反应生成红褐色沉淀 ③Fe3+既具有氧化性,又具有还原性 ④Fe3+的水溶液滴入KSCN试液后,立即出现红色.
①溶液呈浅绿色 ②与碱反应生成红褐色沉淀 ③Fe3+既具有氧化性,又具有还原性 ④Fe3+的水溶液滴入KSCN试液后,立即出现红色.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
18.下列说法正确的是( )
| A. | 二氧化碳、甲烷、水汽等都是重要的温室气体 | |
| B. | 化学反应一定伴随能量变化,有能量变化也一定伴随化学反应 | |
| C. | 反应物所具有的总能量比生成物所具有的总能量高的反应是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应的△H<0 |
2.从化学看生活,你认为下列说法不合理的是( )
| A. | 镁铝合金质量轻、强度大,可用作高铁车厢材料 | |
| B. | 用纸制品、聚乳酸等物质来替代聚乙烯产品,以减少白色污染 | |
| C. | 明矾可用于水的消毒、杀菌 | |
| D. | 大量燃烧化石燃料,是造成雾霾天气的一种原因 |
3.根据原子结构或元素周期律的知识,下列说法正确的是( )
| A. | 35Cl和37Cl中子数不同,所以它们的原子结构示意图、电子式、核外电子排布式、轨道表达式都不相同 | |
| B. | 两个不同原子的1s、2s、2p、3s、3P各亚层中电子的能量相同 | |
| C. | 短周期主族元素原子最外层电子数一定等于其最高化合价 | |
| D. | CO2通入Na2SiO3溶液中可以得到硅酸 |
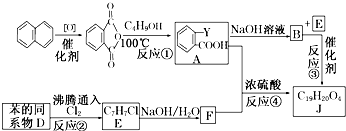
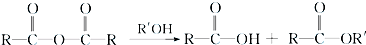
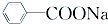 +RCl→
+RCl→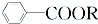 +NaCl;
+NaCl; .
. .
.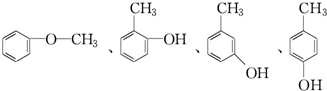 .
.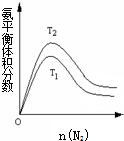 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: