题目内容
16.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s时生成0.1mol H2,则以HI表示该时段的化学反应速率是( )| A. | 0.05 mol•Lˉ1•sˉ1 | B. | 0.1 mol•Lˉ1•sˉ1 | ||
| C. | 0.2 mol•Lˉ1•sˉ1 | D. | 0.8 mol•Lˉ1•sˉ1 |
分析 先根据H2的数据,带入v=$\frac{△n}{V•△t}$计算v(H2),然后根据速率之比等于化学计量数之比计算v(HI).
解答 解:V=1L,△t=2s,△n(H2)=0.1mol,则v(H2)=$\frac{0.1mol}{1L×2s}$=0.05mol•L-1•s-1,由$\frac{v(HI)}{v({H}_{2})}$=$\frac{2}{1}$可得v(HI)=2×0.05mol•L-1•s-1=0.1mol•L-1•s-1,
故选B.
点评 本题考查化学反应速率的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握化学反应速率的定义以及计算公式,难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
6.化学与生活、生产、环境密切相关,下列说法不正确的是( )
| A. | 黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 | |
| B. | 炸油条时,常将小苏打和明矾混用做发酵剂 | |
| C. | 大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | PM2.5颗粒在大气中可形成气溶胶,具有丁达尔效应 |
7.某氢氧固体酸燃料电池的总反应为:2H2+O2=2H2O,其基本结构如图所示:
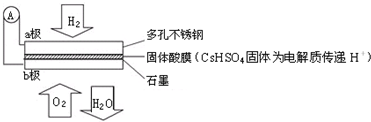
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 电子通过外电路从a极流向b极 | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 电池工作时每转移0.1 mol电子,消耗1.12 LH2 | |
| D. | b极上的电极反应式为:O2+4H++4e-=2H2O |
11.下列各组中,互称为同分异构体的是( )
| A. | O2与O3 | B. | 35Cl与37Cl | C. | CH3CHO与 | D. | CH4与C2H6 |
1.关于常温下pH=11的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水溶液的浓度大于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.001 mol•Lˉ1 | |
| D. | 往两溶液中加入盐酸恰好中和,则反应后溶液的pH值相同 |
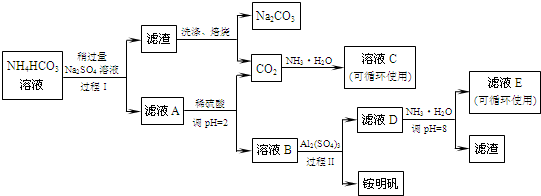
8.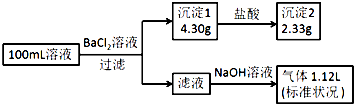 某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
 某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-,可能存在Na+ | |
| C. | 原溶液中c(Cl-)≥0.1mol•L-1 | |
| D. | 若原溶液中不存在Na+,则c(Cl-)<0.1mol•L-1 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+2 c(CO32-)=1.0mol/L | |
| B. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |