题目内容
1.关于常温下pH=11的氨水和氢氧化钠溶液,下列说法正确的是( )| A. | 氨水溶液的浓度大于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.001 mol•Lˉ1 | |
| D. | 往两溶液中加入盐酸恰好中和,则反应后溶液的pH值相同 |
分析 A.NH3•H2O是弱电解质,在溶液中部分电离;
B.弱电解质的电离方程式用可逆号表示;
C.氨水的总浓度大于溶液中氢氧根离子的浓度;
D.氨水与盐酸反应生成氯化铵,氯化铵在溶液中水解.
解答 解:A.NH3•H2O是弱电解质,在溶液中部分电离,所以氨水的浓度大于氢氧根离子的浓度,则氨水溶液的浓度大于氢氧化钠溶液,氢氧化钠的浓度等于氢氧根离子浓度,故A正确;
B.弱电解质的电离方程式用可逆号表示,则NH3•H2O的电离方程式:NH3•H2O?NH4++OH-,故B错误;
C.氨水的总浓度大于溶液中氢氧根离子的浓度,所以c(NH3•H2O)+c(NH4+)>0.001 mol•L-1,故C错误;
D.氨水与盐酸反应生成氯化铵,氯化铵在溶液中水解,溶液显酸性,氢氧化钠与HCl反应生成NaCl溶液显中性,二者的pH不同,故D错误.
故选A.
点评 本题考查了弱电解质的电离和盐的水解,明确弱电解质电离特点是解本题关键,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
| A. | A | B. | B | C. | C | D. | D |
9.实验室有两瓶失去标签的溶液,其中一瓶是K2SO4溶液,另一瓶是NaOH溶液.鉴别时,下列选用的试纸或试剂不正确的是( )
| A. | pH试纸 | B. | 紫色石蕊试液 | C. | Na2CO3固体 | D. | CuCl2溶液 |
16.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s时生成0.1mol H2,则以HI表示该时段的化学反应速率是( )
| A. | 0.05 mol•Lˉ1•sˉ1 | B. | 0.1 mol•Lˉ1•sˉ1 | ||
| C. | 0.2 mol•Lˉ1•sˉ1 | D. | 0.8 mol•Lˉ1•sˉ1 |
6.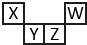 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
13.短周期元素X、Y、Z、W的原子序数依次增大,含W的物质的焰色反应为黄色,X、W同主族,可形成离子化合物WX、Y、Z两种元素形成的化合物是光化学污染的魁首.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | X、Y和Z三种元素形成的化合物中一定含有离子键和共价键 | |
| C. | 化合物YX3溶解于水中促进了水的电离 | |
| D. | Y的最高价氧化物对应的水化物一定有强氧化性 |
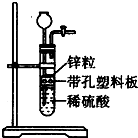 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )