题目内容
4.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液.下列说法正确的是( )| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
分析 电解质溶液为30%的氢氧化钾溶液,则负极反应为2H2+4OH--4e-═4H2O,正极反应为O2+2 H2O+4e-═4OH-,阴离子向负极移动,以此来解答.
解答 解:A.负极上氢气失去电子,则负极反应为:2H2+4OH--4e-═4H2O,故A正确;
B.正极上氧气得到电子,正极反应为O2+2 H2O+4e-═4OH-,故B错误;
C.电池工作时溶液中的阴离子移向负极,故C错误;
D.氢氧根离子浓度越大,pH越大,则电池工作时负极区pH下降,正极区pH升高,故D错误;
故选A.
点评 本题考查原电池,为高频考点,把握电极反应、原电池工作原理为解答的关键,侧重分析与应用能力的考查,注意电解质对电极反应的影响,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
14.若金属钠引起火灾,则下列物质或方法中可用于灭火的是( )
| A. | 水 | B. | 湿布 | C. | 干砂 | D. | 泡沫灭火器 |
15.二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
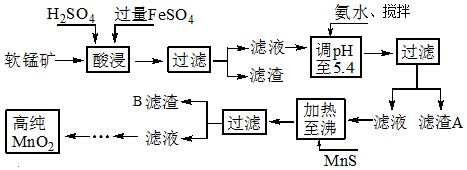
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.
19.化学与社会、生活、技术和环境密切相关.下列有关说法中不正确的是( )
| A. | 有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热 | |
| B. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 苹果放在空气中久置变黄和纸张久置变黄原理不同 |
9.常温下,氨水与硫酸铵的混合液pH=7时,c(SO42-)与 c(NH4+)之比为( )
| A. | 等于1:2 | B. | 小于1:2 | C. | 等于2:1 | D. | 大于2:1 |
16.已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
13.下列有关化学用语表示正确的是( )
| A. | 氨气分子的电子式: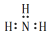 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
8.下列关于催化剂的说法,正确的是( )
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂能改变化学反应速率 | |
| D. | 任何化学反应,都需要催化剂 |