题目内容
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是( )
| A、Ca(OH)2的溶解度、溶剂的质量 |
| B、溶液中溶质的质量分数 |
| C、溶液的质量、水的电离平衡 |
| D、溶液中Ca2+的数目 |
考点:溶解度、饱和溶液的概念
专题:电离平衡与溶液的pH专题
分析:氧化钙与水反应生成氢氧化钙,放出大量的热,氢氧化钙溶解度随着温度的升高而降低,溶解度只与温度有关,据此解答.
解答:
解:A.加入少量CaO,氧化钙与水反应生成氢氧化钙,放出大量的热,消耗溶剂水,不同温度的氢氧化钙溶解度不同,故A错误;
B.温度不变,溶解度不变,质量分数=
×100%,所以质量分数不变,故B正确;
C.加入少量CaO,氧化钙与水反应生成氢氧化钙,消耗溶剂水,溶液的质量减小,温度升高,促进水的电离平衡向正方向进行,故C错误;
D.加入少量CaO,氧化钙与水反应生成氢氧化钙,消耗溶剂水,溶液的质量减小,温度升高,氢氧化钙溶解度降低,所以溶液中所含的钙离子减少,故D错误;
故选:B.
B.温度不变,溶解度不变,质量分数=
| s |
| s+100 |
C.加入少量CaO,氧化钙与水反应生成氢氧化钙,消耗溶剂水,溶液的质量减小,温度升高,促进水的电离平衡向正方向进行,故C错误;
D.加入少量CaO,氧化钙与水反应生成氢氧化钙,消耗溶剂水,溶液的质量减小,温度升高,氢氧化钙溶解度降低,所以溶液中所含的钙离子减少,故D错误;
故选:B.
点评:本题考查了溶解度和饱和溶液的性质,明确溶解度只受温度影响,氢氧化钙溶解度的特点是解题关键,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ/mol.则对于热化学方程式:2H2O(l)=2H2(g)+O2(g)△H2=b,下列说法正确的是( )
| A、热化学方程式中化学计量数表示分子个数 |
| B、该反应的△H2=+483.6 kJ/mol |
| C、△H2<△H1 |
| D、△H2>△H1 |
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、1.8g水中含有中子数为NA |
| B、标准状况下,22.4L CO和C2H4混合气体的总分子数为NA,质量为28g |
| C、1L 0.1mol/L-1稀盐酸中,HCl分子数目为0.1NA |
| D、常温常压下,1mol甲基所含电子数为10NA |
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下的氢气22.4L.据此推断乙一定不是( )
| A、HOCH2CH2OH |
B、 |
C、 |
| D、CH3CH2OH |
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
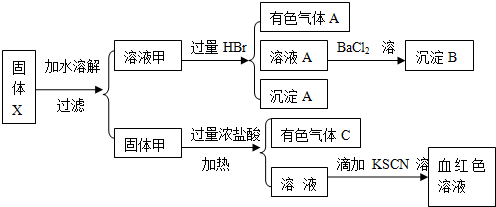
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、原混合物中一定含有Fe2O3 |
| B、气体A一定均为纯净物 |
| C、气体C是纯净的氯气 |
| D、溶液甲中一定含有K2S、K2SO3、NaNO2、K2SO4可能含有KAlO2、K2CO3 |



