题目内容
7. 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
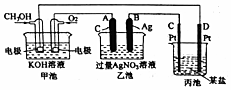
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.
①若交换膜为阳离子交换膜(只允许离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液,则左边发生反应的离子方程式为2H++2Fe2++H2O2=2H2O+2Fe3+,一段时间后右边观察到的现象溶液变为血红色.
②若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2molNH4Fe(SO4)2的溶液,右边充满含4molBa(OH)2的溶液,当有3.5molSO42-通过交换膜时(若反应迅速完成),则左右两边生成沉淀的物质的量之比为4::7,左边发生反应的离子方程式为2Fe3++NH4++7OH-=2Fe(OH)3↓+NH3•H2O.
(3)氮化硅(Si3N4)是一种重要的结构陶瓷材料.
①氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,该陶瓷被氢氟酸腐蚀的化学方程式为Si3N4+16HF=3SiF4↑+4NH4F.
②现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;加热\;}}{\;}$Si3N4+12HCl.
分析 (1)N、S、Fe在自然界中有游离态存在,Na、Mg、Al、Cl、Si在自然界中全部以化合态存在;
(2)亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;当有3.5mol SO42-通过交换膜时,根据电荷守恒则有7molOH-进入左室,铁离子只有2mol,所以左室生成氢氧化铁2mol,剩余1mol氢氧根离子与铵根离子反应生成一水合氨;右室生成3.5mol硫酸钡,则左右两室沉淀的物质的量之比为4:7;
(3)①陶瓷被氢氟酸腐蚀生成四氟化硅和氟化铵;
②四氯化硅和氮气、氢气反应生成氮化硅和氯化氢.
解答 解:(1)Na、Mg、Al、Cl、Si在自然界中全部以化合态存在,N、S、Fe在自然界中有游离态存在,故答案为:N、S、Fe;
(2)①离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;
故答案为:2H++2Fe2++H2O2=2H2O+2Fe3+;溶液变为血红色;
②若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Fe(SO4)2的溶液,右边充满含4mol Ba(OH)2的溶液,当有3.5mol SO42-通过交换膜时(若反应迅速完全),当有3.5mol SO42-通过交换膜时,根据电荷守恒则有7molOH-进入左室,铁离子只有2mol,所以左室生成氢氧化铁2mol,剩余1mol氢氧根离子与铵根离子反应生成一水合氨,反应的离子方程式为2Fe3++NH4++7OH-=2Fe(OH)3↓+NH3•H2O,右室生成3.5mol硫酸钡,则左右两室沉淀的物质的量之比为4:7;故答案为:4:7;2Fe3++NH4++7OH-=2Fe(OH)3↓+NH3•H2O;
(3)①陶瓷被氢氟酸腐蚀生成四氟化硅和氟化铵,反应的化学方程式为:Si3N4+16HF=3SiF4↑+4NH4F;
故答案为:Si3N4+16HF=3SiF4↑+4NH4F;
②四氯化硅和氮气、氢气反应生成氮化硅和氯化氢,化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;加热\;}}{\;}$Si3N4+12HCl;
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;加热\;}}{\;}$Si3N4+12HCl.
点评 本题综合考查了铁、硅及化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,答题数注意把握题干信息和物质性质、方程式书写时应注意依据原子个数守恒配平,题目难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | $\frac{b}{2a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$mol-1 | D. | $\frac{b}{a}$mol-1 |
| 编号 | 纯锌粉 | 0.2 mol/L硫酸溶液 | 温度 | 硫酸铜固体 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
| A. | 选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25 | |
| B. | 待测物理量是收集等体积气体所需要的时间,时间越长,反应速率越大 | |
| C. | 根据该方案,可以探究浓度、温度、固体接触面积对反应速率的影响 | |
| D. | 根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ |
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L HF中含原子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
| A. | c(N2):c(H2)=1:3 | B. | 反应放出92.4 kJ的热量 | ||
| C. | v正(N2)=3v逆(H2) | D. | 容器内气体分子总数不再发生变化 |
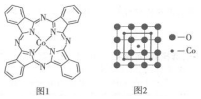 根据所学的物质结构的相关知识回答下列问题:
根据所学的物质结构的相关知识回答下列问题: