题目内容
15.NA代表阿伏加德罗常数值,下列说法正确的是( )| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L HF中含原子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、标况下HF为液体;
C、醋酸为弱电解质,不能完全电离;
D、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析.
解答 解:A、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个原子,故A正确;
B、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、醋酸为弱电解质,不能完全电离,故溶液中的离子个数小于2NA个,故C错误;
D、7.1g氯气的物质的量为0.1mol,而氯气和碱的反应为歧化反应,故0.1mol氯气反应转移0.1NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.常温下某溶液中,由水电离出的c(H+)为1×10-12mol/L,该溶液中一定不能大量共存的离子组是( )
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
6.下列实验操作正确的是( )
| A. | 蒸发:应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 | |
| C. | 分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯 | |
| D. | 量取:用规格为10mL的量筒量取8.0mL液体 |
10.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种有毒的气体 | |
| B. | 氯气、氯水、液氯是同一种物质 | |
| C. | 氯气能与水发生反应 | |
| D. | 氯气是一种黄绿色,有刺激性气味的气体 |
20.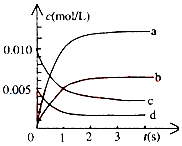 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$,计算:达平衡时,NO的转化率=65%,已知:K(300℃)>K(350℃),该反应是放热反应.(填“放热”或“吸热”)
(2)图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是BC.
A.单位时间内消耗a mol NO,同时生成a mol NO2
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应已经达到平衡状态的是BC.
A.单位时间内消耗a mol NO,同时生成a mol NO2
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂.
4.在一个10L的密闭容器发生反应A(g)+B(g)?C(g)+D(g),测得平衡常数和温度的关系如表:
回答下列问题:
(1)△H< 0(填“<”或“>”).
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5mol,则A的平衡转化率为50%,
②该温度下平衡常数K=1.
(3)判断该反应是否达到平衡的依据为ad
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为2.5.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
(1)△H< 0(填“<”或“>”).
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5mol,则A的平衡转化率为50%,
②该温度下平衡常数K=1.
(3)判断该反应是否达到平衡的依据为ad
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为2.5.
14.将0.010 0mol•L-1的 NaOH 溶液滴入浓度为0.010 0mol•L-1,体积为20.00mL的 CH3COOH 溶液.在滴加过程中n(CH3COOH) 和n(CH3COO-) 随溶液 pH 的分布关系如图.下列说法不正确的是( )

| A. | pH=4 时,醋酸的电离常数Ka≈1.8×10-5 | |
| B. | B点时,c(CH3COOˉ)=c(CH3COOH) | |
| C. | B点时,在溶液中滴入酚酞试剂,溶液显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ |
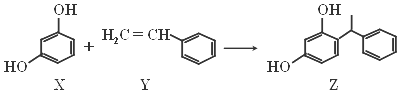
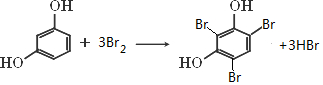
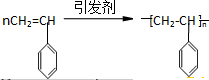
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).