题目内容
18.为了探究温度、不活泼金属杂质对锌与稀硫酸反应速率的影响,设计如下方案:| 编号 | 纯锌粉 | 0.2 mol/L硫酸溶液 | 温度 | 硫酸铜固体 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
| A. | 选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25 | |
| B. | 待测物理量是收集等体积气体所需要的时间,时间越长,反应速率越大 | |
| C. | 根据该方案,可以探究浓度、温度、固体接触面积对反应速率的影响 | |
| D. | 根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ |
分析 A.要选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,只有硫酸铜不同,其余条件都相同;
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越慢;
C.硫酸浓度不同会导致其反应速率不同;
D.温度越高反应速率越快,原电池加快反应速率.
解答 解:A.要选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,只有硫酸铜不同,其余条件都相同,所以必须控制t=35,故A错误;
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越慢,故B错误;
C.硫酸浓度、温度以及固体表面积不同,会导致其反应速率不同,所以根据该方案,可以探究浓度、温度、固体接触面积对反应速率的影响,故C正确;
D.温度越高反应速率越快,原电池加快反应速率,III、IV温度相同且都能形成原电池,且IV形成的原电池中金属面积大于III导致反应速率IV>III,故D错误;
故选C.
点评 本题考查化学反应速率影响因素的探究,为高频考点,侧重考查学生综合分析判断能力,注意:温度对化学反应速率影响大于浓度对化学反应速率影响,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
8.某温度下,在一容积可变的密闭容器里,反应2A(g)?B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol.在保持温度和压强不变的条件下,下列说法正确的是( )
| A. | 充入1mol稀有气体氦(He),平衡将不发生移动 | |
| B. | 充入A、B、C各1mol,平衡将向正反应方向移动 | |
| C. | 将A、B、C各物质的物质的量都减半,C的百分含量不变 | |
| D. | 加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动 |
9.已知某化学实验的结果如表:
下列结论正确的是( )
| 实验序号 | 反应物 | 在相同温度下测得的反应速率v/mol•L-1•min-1 | |
| 大小相同的金属片 | 酸溶液 | ||
| 1 | 镁条 | 1 mol•L-1盐酸 | v1 |
| 2 | 铁片 | 1 mol•L-1盐酸 | v2 |
| 3 | 铁片 | 0.1 mol•L-1盐酸 | v3 |
| A. | v1>v2>v3 | B. | v3>v2>v1 | C. | v1>v3>v2 | D. | v2>v3>v1 |
6.下列实验操作正确的是( )
| A. | 蒸发:应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 | |
| C. | 分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯 | |
| D. | 量取:用规格为10mL的量筒量取8.0mL液体 |
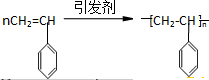
13.下列物质既能发生消去反应,又能氧化成醛的是( )
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. |  | D. |  |
10.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种有毒的气体 | |
| B. | 氯气、氯水、液氯是同一种物质 | |
| C. | 氯气能与水发生反应 | |
| D. | 氯气是一种黄绿色,有刺激性气味的气体 |
17.下列叙述中,正确的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等体积的CO与CO2中所含碳原子数之比为1:1 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |



 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).