题目内容
2.25℃时,HF的Ka=6.4×10-4,则此温度下0.1mol•L-1HF溶液的c(H+)为6×10-3mol•L-1.分析 已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中HF?H++F-,Ka(HF)=$\frac{[{H}^{+}]•[{F}^{-}]}{[HF]}$,计算得到c(H+).
解答 解:已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中HF?H++F-,Ka(HF)=$\frac{[{H}^{+}]•[{F}^{-}]}{[HF]}$,c(H+)=$\sqrt{Ka×c(HF)}$=$\sqrt{3.6×1{0}^{-4}×0.1}$
=6×10-3mol/L,
故答案为:6×10-3.
点评 本题考查了据弱电解质的电离平衡常数计算氢离子浓度的方法,题目难度不大,熟记电离平衡常数的表达式即可.

练习册系列答案
相关题目
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
13.下列物质既能发生消去反应,又能氧化成醛的是( )
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. |  | D. |  |
10.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种有毒的气体 | |
| B. | 氯气、氯水、液氯是同一种物质 | |
| C. | 氯气能与水发生反应 | |
| D. | 氯气是一种黄绿色,有刺激性气味的气体 |
17.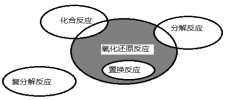 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )| A. | CuSO4+Mg=Cu+MgSO4 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
14.已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
| A. | 8838Sr的中子数为38 | B. | 最高化合价为+2 | ||
| C. | 原子半径:Sr>Ca | D. | 氢氧化物为强碱 |
11.如图所示实验装置,下列说法不正确的是( )


| A. | 装置为铁的吸氧腐蚀实验 | |
| B. | 一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀 | |
| C. | 向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红 | |
| D. | 若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀 |
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).