题目内容
9.在1000mL含等物质的量的HI和H2SO3的溶液里通入0.25molCl2,有二分之一的HI变为I2(已知反应:I2+H2SO3+H2O=4H++SO42-+2I-).原溶液中HI和H2SO3的浓度都等于( )| A. | 0.2 mol•L-1 | B. | 0.1 mol•L-1 | C. | 2.0 mol•L-1 | D. | 1.0 mol•L-1 |
分析 已知I2+H2SO3+H2O=4H++SO42-+2I-,说明I2能氧化H2SO3,向含有HI和H2SO3的溶液里通入氯气,氯气先和亚硫酸反应生成硫酸,然后氯气再和碘离子反应生成碘单质,根据氧化还原反应中得失电子守恒计算原溶液中HBr和H2SO3的浓度.
解答 解:由I2+H2SO3+H2O=4H++SO42-+2I-可知,I2能氧化H2SO3,向含有HI和H2SO3的溶液里通入氯气,氯气先和亚硫酸反应生成硫酸,然后氯气再和碘离子反应生成碘单质,通入0.25molCl2,有二分之一的HI变为I2,
设原溶液中HI和H2SO3的浓度均为x,由电子守恒可知:
1L×x×(6-4)+1L×x×(1-0)×$\frac{1}{2}$=0.25×2×(1-0),
解得:x=0.2mol•L-1,
故选A.
点评 本题考查氧化还原反应的计算,为高考常见题型,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意把握还原性的强弱及电子守恒为解答的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素 ( )
| A. | 一定是第2周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第2、3周期元素 | D. | 可以相互化合形成化合物 |
17.下列属于固氮作用的化学反应是( )
| A. | N2和H2在一定条件下反应生成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3催化氧化生成NO和H2O | D. | 由NH3制NH4HCO3和(NH4)2SO4 |
14.图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( )
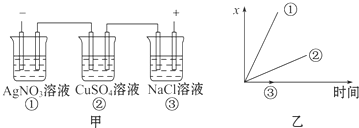

| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
1.下列说法中正确的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,沸点依次升高 | |
| B. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏离子键和共价键 | |
| C. | 熔融状态下能导电的化合物一定含离子键 | |
| D. | CS2、BF3分子中所有的原子均为8电子稳定结构 |
18.常温下,1mol某烷烃在光照条件下与氯气发生取代反应,若在适当的条件下,完全取代需要消耗6mol Cl2,则下列判断正确的是( )
| A. | 该烷烃的分子式为C5H12 | |
| B. | 反应所生成的有机产物能直接使AgNO3溶液褪色 | |
| C. | 该烷烃的四氯代物有2种 | |
| D. | 反应容器中,一氯代物所占的物质的量分数最大 |
19.对于反应A(g)+3B(g)??2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
( )
( )
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
 .
. 
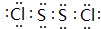 ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的化学方程式:2S2Cl2+2H2O=3S+SO2↑+4HCl;
;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的化学方程式:2S2Cl2+2H2O=3S+SO2↑+4HCl;