题目内容
1.下列说法中正确的是( )| A. | HF、HCl、HBr、HI的热稳定性依次减弱,沸点依次升高 | |
| B. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏离子键和共价键 | |
| C. | 熔融状态下能导电的化合物一定含离子键 | |
| D. | CS2、BF3分子中所有的原子均为8电子稳定结构 |
分析 A.非金属性越强,其氢化物越稳定,HF分子间含有氢键,沸点最高,HCl、HBr、HI,都不含氢键,都为分子晶体,影响因素为相对分子质量大小;
B.NaHSO4晶体中阴、阳离子的个数是1:1且熔化时破坏的是离子键;
C.熔融状态下能导电的化合物中含自由移动的离子;
D.共价化合物分子中元素原子最外层电子数+|该元素化合价|(或共价键数目)=8,该元素原子满足8电子结构.
解答 解:A.同一主族,从上到下,元素的非金属性逐渐减弱,所以非金属性:F>Cl>Br>I,元素非金属性越强,其氢化物越稳定,所以热稳定性:HF>HCl>HBr>HI;HF分子间含有氢键,沸点最高,HCl、HBr、HI,都不含氢键,都为分子晶体,决定熔沸点高低的因素是分子间作用力,相对分子质量越大,分子间作用力越强,则熔沸点越高,HCl、HBr、HI沸点却依次升高,故A错误;
B.NaHSO4是强电解质,NaHSO4在熔化时电离出钠离子和硫酸氢根离子,NaHSO4═Na++HSO4-,阴、阳离子的个数是1:1且熔化时破坏的是离子键,故B错误;
C.熔融状态能导电的化合物一定是离子化合物,只有离子化合物在熔融状态下电离出自由移动的离子,一定含离子键,故C正确;
D.CS2分子中C原子最外层电子数为4+4=8、S原子最外层电子数=6+|-2|=8,均满足8电子结构,BF3分子中B原子最外层电子数为3+3=6,不满足8电子结构,故D错误.
故选C.
点评 本题考查化学键和化合物的类型,注意HF分子间含有氢键、NaHSO4在熔化时电离出钠离子和硫酸氢根离子,题目难度中等.

练习册系列答案
相关题目
11.实验室制备下列气体时,所用方法不正确的是( )
| A. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制乙烯时,不能用向上排空气法收集气体 | |
| D. | 制二氧化氮时,用NaOH溶液吸收尾气 |
12.下列分子中所有碳原子不可能处在同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
9.在1000mL含等物质的量的HI和H2SO3的溶液里通入0.25molCl2,有二分之一的HI变为I2(已知反应:I2+H2SO3+H2O=4H++SO42-+2I-).原溶液中HI和H2SO3的浓度都等于( )
| A. | 0.2 mol•L-1 | B. | 0.1 mol•L-1 | C. | 2.0 mol•L-1 | D. | 1.0 mol•L-1 |
16.下列有关叙述错误的是( )
| A. | 苯、甲苯、邻二甲苯、间二甲苯,它们之间都属于同系物 | |
| B. | 为了延长花果的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯 | |
| C. | 反应2CH3CHO+O2→2CH3COOH的原子利用率为100%,符合绿色化学理念 | |
| D. | 乙烯分子的球棍模型为: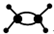 |
13.Cu2O是一种半导体材料,基于绿色化学理念设计的一制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )


| A. | 石墨电极上产生氢气 | |
| B. | 铜电极被还原 | |
| C. | 铜电极接直流电源的负极 | |
| D. | 当有1 mol电子转移时,有1 mol Cu2O生成 |
10.下列说法正确的是( )
| A. | 二氧化碳通入水玻璃可以得到硅酸 | |
| B. | 水泥、玻璃、陶瓷、水晶都属于硅酸盐产品 | |
| C. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| D. | 可以用澄清石灰水鉴别SO2和CO2 |
11.某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的有机物可用C6H10O5表示[交换膜分别是只允许阴(阳)离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是( )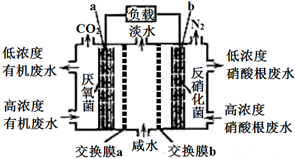

| A. | 电池工作时,电子由a极经导线流向b极 | |
| B. | 交换膜a是阴离子交换膜 | |
| C. | 电极b的反应式:2NO3-+10e-+6H2O=N2↑+12OH- | |
| D. | 相同时间内(相同状况下)生成CO2和N2的体积比为5:2 |