题目内容
8.下列说法正确的是( )| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
分析 A.pH=0的溶液,显酸性;
B.NH4+水解;
C.NO与空气中的氧气反应;
D.MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,生成1molS,转移2mol电子.
解答 解:A.pH=0的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.NH4+水解,则1 L浓度为l mol•L-1的NH4Cl溶液中含小于NA个NH4+,故B错误;
C.NO与空气中的氧气反应,则不能利用空气法收集NO,故C错误;
D.MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,生成1molS,转移2mol电子,则每析出12.8 g S共转移电子为$\frac{12.8g}{32g/mol}$×2=0.8mol,故D正确;
故选D.
点评 本题考查较综合,涉及离子共存、盐类水解、氧化还原反应计算等,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,为高考常见的冷拼试题,注重学生思维及时转换的训练,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
19.来氟米特适用于成人类风湿关节炎,如下为其结构简式.下列关于来氟米特的说法正确的是( )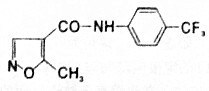

| A. | 分子式为C12H10F3N2O2 | B. | 可以发生水解反应和氧化反应 | ||
| C. | 该化合物易溶于水,难溶于酒精 | D. | 该化合物所有碳原子不可能共平面 |
16.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
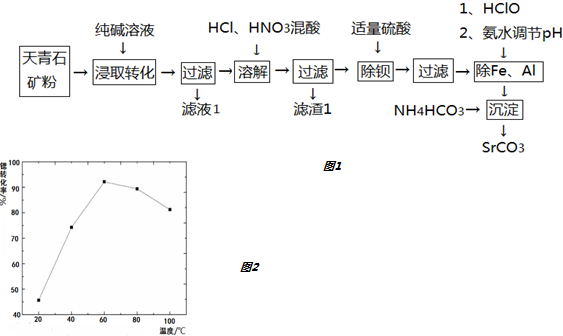
20.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素.用天青石(主要成分为SrSO4,含有少量BaCO3、FeO、Fe2O3、Al2O3、SiO2等)制备SrCO3,工艺流程如图1:
已知:
(1)“浸取转化”过程中发生的化学方程式为:SrSO4+Na2CO3=SrCO3+Na2SO4;当转化完全时,混合液中的c(CO32-)=1.0×10-3 mol•L-1,则c(SO42-)=2.0mol/L.
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.

已知:
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.
17. 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
18.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍,下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | W的氧化物的水化物酸性一定比Z的强 |
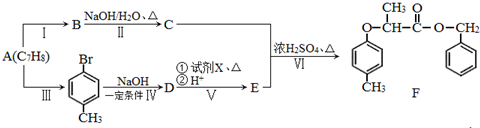

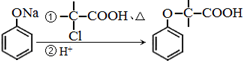
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$  +NaCl.
+NaCl. .
. 为原料制取
为原料制取 的合成路线图.
的合成路线图. }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: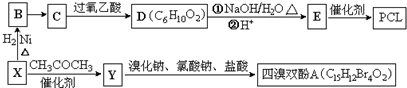
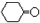
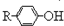 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$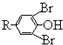
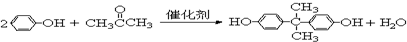 .
.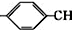 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3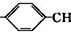 =CHCOOR+2H2O
=CHCOOR+2H2O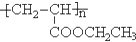 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: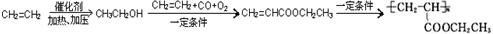 .
.