题目内容
13.工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{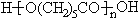 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: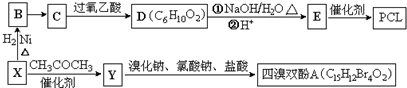
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为
②
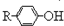 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$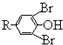
③RCOCH2R′$\stackrel{过氧乙酸}{→}$RCOOCH2R′
请回答下列问题:
(1)X的分子式为C6H6O;B的名称是环己醇.
(2)B→C还需要的反应试剂及条件是O2、Cu、加热.C→D的反应类型是氧化反应.
(3)写出X→Y的化学方程式:
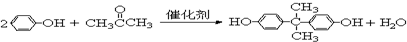 .
.(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗5molNaOH.
(5)符合以下条件的D的同分异构体有10种(不考虑空间异构).
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
2CH3
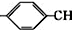 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3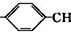 =CHCOOR+2H2O
=CHCOOR+2H2O利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: .
.
分析 X的蒸汽密度是相同条件下H2的47倍,其相对分子质量为47×2=94,遇FeCl3溶液显紫色,说明含有酚羟基,则X为 ,X和氢气发生加成反应生成B为
,X和氢气发生加成反应生成B为 ,C为
,C为 ,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为
,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为 .根据题给信息②知,Y结构简式为
.根据题给信息②知,Y结构简式为 ,四溴双酚A结构简式为
,四溴双酚A结构简式为 .
.
(6)一定条件下乙烯和水发生加成反应生成CH3CH2OH,CH3CH2OH和CH2=CH2、CO、O2反应生成CH2=CHCOOCH2CH3,CH2=CHCOOCH2CH3发生加聚反应生成高分子化合物.
解答 解:X的蒸汽密度是相同条件下H2的47倍,其相对分子质量为47×2=94,遇FeCl3溶液显紫色,说明含有酚羟基,则X为 ,X和氢气发生加成反应生成B为
,X和氢气发生加成反应生成B为 ,C为
,C为 ,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为
,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,结合信息可知D的结构简式为 .根据题给信息②知,Y结构简式为
.根据题给信息②知,Y结构简式为 ,四溴双酚A结构简式为
,四溴双酚A结构简式为 .
.
(1)X为苯酚,其分子数为C6H6O,B为环己醇,故答案为:C6H6O;环己醇;
(2)B→C还需要的反应试剂及条件是O2、Cu、加热,C生成D的反应是氧化反应,故答案为:O2、Cu、加热;氧化反应;
(3)X→Y的化学方程式: ,
,
故答案为: ;
;
(4)四溴双酚A能和NaOH溶液发生取代反应后生成的酚羟基、HBr能和NaOH发生中和反应,0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗5molNaOH,
故答案为:5;
(5)D结构简式为 ,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键; ③能发生银镜反应说明含有醛基,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种,
,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键; ③能发生银镜反应说明含有醛基,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种,
故答案为:10;
(6)一定条件下乙烯和水发生加成反应生成CH3CH2OH,CH3CH2OH和CH2=CH2、CO、O2反应生成CH2=CHCOOCH2CH3,CH2=CHCOOCH2CH3发生加聚反应生成高分子化合物,其流程图为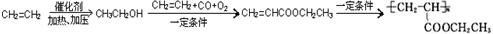 ,
,
故答案为: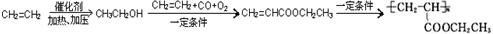 .
.
点评 本题考查有机推断和有机合成,侧重考查学生分析推理及知识综合应用能力,注意对题目给予信息的理解,熟练掌握官能团的性质与衍变,(5)中限制条件同分异构体的书写为易错点、难点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )| A. | 整个过程的能量转化只涉及化学能转化为电能 | |
| B. | 放电时正极反应为:Li1+xV3O8-xe?═LiV3O8+xLi+ | |
| C. | 放电时Cl?移向LiV3O8电极 | |
| D. | Li-Si合金熔点高于352℃ |
| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | W的氧化物与X、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:W>Z>Y | |
| D. | 单质的氧化性:Y>W |
| A. | 铵明矾中加入过量的氢氧化钡溶液的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol | |
| C. | 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ | |
| D. | 将过量SO2通入少量氨水中的离子方程式为:SO2+2NH3•H2O═2NH4++SO32- |
| A. | 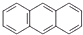 (蒽)和 (蒽)和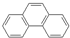 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 | |
| B. | 一般不能使用过酸的洗涤剂洗涤棉织品和丝织品,不能使用过碱的洗涤剂洗涤氨纶(聚氨基甲酸酯纤维)、腈纶(聚丙烯腈)等合成纤维制品 | |
| C. | 异黄酮类物质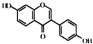 和酚类物质 和酚类物质 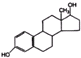 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) | |
| D. | 一定条件下将总质量相等的CH3OH、CH3COOH混合物或HCOOH、HOCOOCH2OH混合物在氧气中完全燃烧,燃烧后的全部产物通入足量过氧化钠层,过氧化钠层增加的质量之比为23:15 |
 .
.
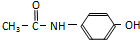 )是常用的消炎解热镇痛药.其合成路线如下:
)是常用的消炎解热镇痛药.其合成路线如下:
 →
→ 的反应类型为还原反应.
的反应类型为还原反应. →
→ 反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯.
反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯. 与
与 的性质相似,写出一定条件下
的性质相似,写出一定条件下 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式 .
.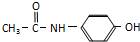 的同分异构体有3种.
的同分异构体有3种. )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.