题目内容
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
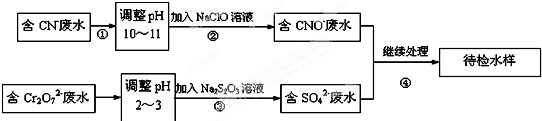
回答下列问题:
(1)上述处理废水流程中主要采用的方法是 .
(2)流程②中,反应后无气体放出,该反应的离子方程式为 .
(3)含Cr3+废水需进一步处理,请你设计一个处理方案: .
(4)反应③中,每消耗0.4mol Cr2O72-转移2.4mol e-,该反应离子方程式为 _.
(5)处理1m3含有2×10-2 mol?L-1Cr2O72-的工业废水,需要Na2S2O3的质量为 千克.

回答下列问题:
(1)上述处理废水流程中主要采用的方法是
(2)流程②中,反应后无气体放出,该反应的离子方程式为
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:
(4)反应③中,每消耗0.4mol Cr2O72-转移2.4mol e-,该反应离子方程式为
(5)处理1m3含有2×10-2 mol?L-1Cr2O72-的工业废水,需要Na2S2O3的质量为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样;
(1)从流程分析物质的转化关系和试剂选择分析所用方法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)依据反应的定量关系结合离子方程式计算.
(1)从流程分析物质的转化关系和试剂选择分析所用方法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)依据反应的定量关系结合离子方程式计算.
解答:
解:(1)从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:氧化-还原法;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去,
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,
则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)处理1m3含有2×10-2 mol?L-1Cr2O72-的工业废水,发生反应:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
3 4
n 1000dm3×2×10-2 mol?L-1,
n=15mol
需要Na2S2O3的质量=15mol×158g/mol=2370g=2.37kg
故答案为:2.37.
故答案为:氧化-还原法;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去,故调节废水pH,使其转化成Cr(OH)3沉淀除去,
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,
则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)处理1m3含有2×10-2 mol?L-1Cr2O72-的工业废水,发生反应:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
3 4
n 1000dm3×2×10-2 mol?L-1,
n=15mol
需要Na2S2O3的质量=15mol×158g/mol=2370g=2.37kg
故答案为:2.37.
点评:本题考查了氧化还原反应,沉淀溶解平衡知识,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、离子方程式计算等来解答,题目难度中等.

练习册系列答案
相关题目
下列溶液中Cl-浓度与50mL 1mol?L-1 AlCl3溶液中Cl-浓度相等的是( )
| A、150 mL 3 mol?L-1的KCl溶液 |
| B、75 mL 2.5 mol?L-1的CaCl2溶液 |
| C、150 mL 3 mol?L-1KClO3溶液 |
| D、25 mL 2 mol?L-1的FeCl3溶液 |
下列实验能达到目的是( )
| A、用盐酸酸化的BaCl2溶液来判断亚硫酸钠固体是否发生变质 |
| B、实验室用加热NH4Cl的方法来制取氨气 |
| C、可加入足量的铜粉然后过滤来除去氯化亚铁溶液中的少量氯化铁 |
| D、加入澄清石灰水看是否有白色沉淀来区别碳酸钠溶液和碳酸氢钠溶液 |
根据某种共性,可将SO2、CO2归为同一类物质.下列物质中也属于这类的是( )
| A、CaCO3 |
| B、SO3 |
| C、KMnO4 |
| D、Na2O |
下列实验方法正确的是( )
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| C、区别FeCl3溶液和Fe(OH)3胶体时,可将它们分别用一束光照射,看有无丁达尔效应出现 |
| D、检验某溶液中是否含有Fe3+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe3+ |
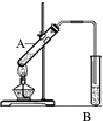 (1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
(1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
 分析化学中常用X射线研究晶体的结构.有一种晶体KxFey(CN)z,其中Fe2+、Fe3+、CNˉ的排布如图所示,其中Fe2+和Fe3+位于立方体的顶点,自身互不相邻,CNˉ位于立方体的棱上,每隔一个立方体,在立方体的中心含有一个K+(未画出).
分析化学中常用X射线研究晶体的结构.有一种晶体KxFey(CN)z,其中Fe2+、Fe3+、CNˉ的排布如图所示,其中Fe2+和Fe3+位于立方体的顶点,自身互不相邻,CNˉ位于立方体的棱上,每隔一个立方体,在立方体的中心含有一个K+(未画出).