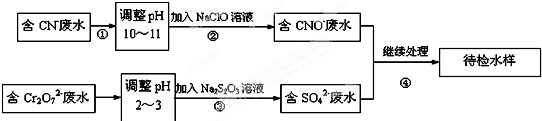
题目内容
 分析化学中常用X射线研究晶体的结构.有一种晶体KxFey(CN)z,其中Fe2+、Fe3+、CNˉ的排布如图所示,其中Fe2+和Fe3+位于立方体的顶点,自身互不相邻,CNˉ位于立方体的棱上,每隔一个立方体,在立方体的中心含有一个K+(未画出).
分析化学中常用X射线研究晶体的结构.有一种晶体KxFey(CN)z,其中Fe2+、Fe3+、CNˉ的排布如图所示,其中Fe2+和Fe3+位于立方体的顶点,自身互不相邻,CNˉ位于立方体的棱上,每隔一个立方体,在立方体的中心含有一个K+(未画出).(1)晶体的化学式可以表示为
(2)1molKxFey(CN)z晶体中含有π键的个数为
考点:晶胞的计算
专题:
分析:(1)利用均摊法计算出各种微粒在晶胞中数目;
(2)根据晶胞中C≡N数目判断.
(2)根据晶胞中C≡N数目判断.
解答:
解:(1)Fe2+数=Fe3+数=4×
=
,即化学式中含Fe数目=
;CN-位于棱,数目=12×
,两个晶胞含有一个K+,一个晶胞含有
个K+,即化学式可写为:KFe2(CN)6,
故答案为:KFe2(CN)6;
(2)1molCN-中含有2molπ键,故1molK1Fe2(CN)6晶体中含有2mol×6=12molπ键,故答案为:12NA.
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
故答案为:KFe2(CN)6;
(2)1molCN-中含有2molπ键,故1molK1Fe2(CN)6晶体中含有2mol×6=12molπ键,故答案为:12NA.
点评:本题考查物质结构与性质,涉及化学键和晶胞计算等知识点,难度较小,解题时要注意均摊法的应用.

练习册系列答案
相关题目
在给定条件下,下列离子一定能大量共存的是( )
| A、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | ||
B、
| ||
| C、含有大量Al3+ 的溶液中:Br- HCO3- Na+ AlO2- | ||
| D、向含有Ca2+,Cl-,NO3-,Ba2+的溶液通入CO2气体 |
在一定条件下,可逆反应X(g)+3Y(g)=2Z(g) 达到反应限度时,有25%的X转化为Z,有37.5%的Y转化为Z,则开始时充入容器中的X和Y的物质的量之比为( )
| A、1:2 | B、2:1 |
| C、1:3 | D、3:1 |
下列元素的原子序数为5的是( )
| A、H | B、Li | C、B | D、P |
反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A、在密闭容器中通入水蒸气 |
| B、升温 |
| C、保持体积不变,充入氦气使体系压强增大 |
| D、保持压强不变,充入氦气使容器体积增大 |
将2.24g的铁粉加入50ml2mol?L-1的氯化铁溶液中,充分反应后,其结果是( )
| A、铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B、往溶液中滴入KSCN无色溶液,不显红色 |
| C、氧化产物与还原产物的物质的量之比为2:5 |
| D、Fe2+、Fe3+的物质的量之比为6:1 |