题目内容
7.下列有关物质分类的正确组合是( )| 分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子(或铵根离子)和酸根离子组成的化合物,根据以上概念分析;
碱性氧化物是和酸反应生成盐和水的 氧化物;
酸性氧化物是和碱反应生成盐和水的氧化物.
解答 解:A.碳酸钠是盐,不是碱,二氧化硅为酸性氧化物,故A错误;
B.选项中CO为不成盐氧化物,不是酸性氧化物,故B错误;
C.选项中过氧化钠和酸反应,生成盐、水和氧气,发生的是氧化还原反应,不是碱性氧化物,故C错误;
D.KOH属于碱,HNO3属于酸,CaCO3属于盐,CaO属于碱性氧化物,SO3属于酸性氧化物,故D正确;
故选D.
点评 本题考查了物质分类方法和概念实质理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
17.下列实验操作正确的是( )
| A. | 测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 | |
| B. | 容量瓶用蒸馏水洗净后,必须烘干才能用于溶液的配制 | |
| C. | 用四氯化碳萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | |
| D. | 中和滴定时,锥形瓶不能用待测液润洗 |
15.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 17 g甲基(-14CH3)所含中子数为9 NA | |
| B. | 常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| C. | 0.1 mol C5H12分子中含有的C-C键数为0.5 NA | |
| D. | 标准状况下,2.24 L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA |
12.下列说法中正确的是( )
| A. | 1mol/LNa2CO3溶液中有2NA个Na+ | |
| B. | 1L0.1mol/LCuSO4溶液中Cu2+有0.1NA个 | |
| C. | 常温下在PH=1或PH=13的溶液中均不可能有大量的HCO3- | |
| D. | 0.1mol/LCH3COONa溶液的PH=10,则说明CH3COONa是弱电解质 |
19.某无色混合气体含有NH3、HCl、SO2、Cl2、CO2、O2中的几种.将气体先通过浓硫酸,气体体积明显减小;再通过品红溶液,品红溶液褪色;最后通过澄清石灰水,石灰水变浑浊.下列推断错误的是( )
| A. | 肯定存在CO2 | B. | 可能存在O2 | C. | 肯定不存在HCl | D. | 肯定存在NH3 |
2.标准状态下,现在一固定容积的容器盛满NO、O2、NO2混合气体,将该容器倒置在水中,充分反应后无剩余气体,所得溶液的物质的量为m mol/L则m( )
| A. | $\frac{1}{39.2}$<m<$\frac{1}{28}$ | B. | $\frac{1}{39.2}$<m<33.6 | C. | 0<m<$\frac{1}{22.4}$ | D. | $\frac{1}{28}$<$\frac{1}{22.4}$ |
3.下列关于${\;}_{2}^{3}$He的说法正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有2个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的元素 |
 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.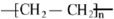 .
.