题目内容
14.某学生设计如图实验步骤测定铁铜合金的组成: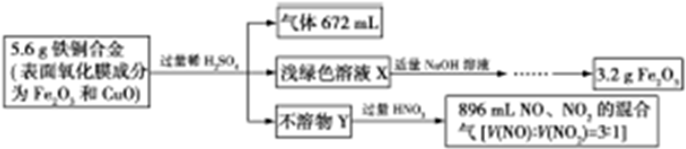
说明:以上所有气体体积都已换算成标准状况时的数据
下列说法正确的是( )
| A. | 不溶物Y为Cu且质量是1.6g | |
| B. | 合金中铁单质的质量是1.68g | |
| C. | 合金中氧元素的物质的量是0.01mol | |
| D. | X溶液中既含有CuSO4又含有FeSO4 |
分析 将5.6gFe、Cu合金(表面氧化膜成分为Fe2O3和CuO)加入到过量稀硫酸中,完全反应后产生气体672mL为氢气体积,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,反应生成氢气消耗的铁的质量为56×0.03g=1.68g,得到浅绿色溶液X,加入氢氧化钠沉淀,最终得到氧化铁,硫酸过量,所以X含有Fe2+、H+,不含Cu2+,则不溶物Y为Cu;将Cu加入到适量的某浓度的硝酸中,完全溶解后,得NO、NO2的混合气896mL,混合气体总物质的量=$\frac{0.896L}{22.4L/mol}$=0.04mol,该混合气中V(NO):V(NO2)=3:1,故n(NO)=0.04mol×$\frac{3}{4}$=0.03mol,n(NO2)=0.04mol-0.03mol=0.01mol,根据电子转移守恒,n(Cu)=$\frac{0.03mol×3+0.01mol×1}{2}$=0.05mol,故m(Cu)=0.05mol×64g/mol=3.2g;在3.2g氧化铁中含有铁元素的质量为$\frac{112}{160}$×3.2g=2.24g,根据元素守恒,可知合金中m(O)=m(合金)-m(Cu元素)-m(Fe元素)=5.6g-3.2g-2.24g=0.16g,故合金中n(O元素)=$\frac{0.16g}{16g/mol}$=0.01mol,据此答题.
解答 解:将5.6gFe、Cu合金(表面氧化膜成分为Fe2O3和CuO)加入到过量稀硫酸中,完全反应后产生气体672mL为氢气体积,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,反应生成氢气消耗的铁的质量为56×0.03g=1.68g,得到浅绿色溶液X,加入氢氧化钠沉淀,最终得到氧化铁,硫酸过量,所以X含有Fe2+、H+,不含Cu2+,则不溶物Y为Cu;将Cu加入到适量的某浓度的硝酸中,完全溶解后,得NO、NO2的混合气896mL,混合气体总物质的量=$\frac{0.896L}{22.4L/mol}$=0.04mol,该混合气中V(NO):V(NO2)=3:1,故n(NO)=0.04mol×$\frac{3}{4}$=0.03mol,n(NO2)=0.04mol-0.03mol=0.01mol,根据电子转移守恒,n(Cu)=$\frac{0.03mol×3+0.01mol×1}{2}$=0.05mol,故m(Cu)=0.05mol×64g/mol=3.2g;在3.2g氧化铁中含有铁元素的质量为$\frac{112}{160}$×3.2g=2.24g,根据元素守恒,可知合金中m(O)=m(合金)-m(Cu元素)-m(Fe元素)=5.6g-3.2g-2.24g=0.16g,故合金中n(O元素)=$\frac{0.16g}{16g/mol}$=0.01mol,
A.根据上面的分析可知,m(Cu)=0.05mol×64g/mol=3.2g,故A错误;
B.根据上面的分析可知,n(H2)═0.03mol,根据铁和氢气的关系式知,生成氢气消耗m(Fe)=0.03mol×56g/mol=1.68g,铁还和铜离子、铁离子反应,所以铁的总质量大于1.68g,故B错误;
C.根据④知合金中n(O元素)=$\frac{0.16g}{16g/mol}$=0.01mol,故C正确;
D.根据上面的分析可知,X中含有Fe2+、H+,故D错误;
故选C.
点评 本题考查了混合物的计算,根据生成氢气的体积确定铁的质量、根据转移电子守恒计算Cu的质量、铁元素的物质的量,再根据质量守恒计算O元素的物质的量,同时考查学生考虑问题的缜密性,注意守恒思想的应用,题目难度中等.

| A. | 肯定存在CO2 | B. | 可能存在O2 | C. | 肯定不存在HCl | D. | 肯定存在NH3 |
| A. | $\frac{1}{39.2}$<m<$\frac{1}{28}$ | B. | $\frac{1}{39.2}$<m<33.6 | C. | 0<m<$\frac{1}{22.4}$ | D. | $\frac{1}{28}$<$\frac{1}{22.4}$ |
| A. | 将废弃的塑料袋回收进行露天焚烧,以解决“白色污染”问题 | |
| B. | 煤的干馏和石油的分馏均属于化学变化 | |
| C. | 用浸泡过的高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 福尔马林用于保存海鲜产品 |
| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有2个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的元素 |
| A. |  浓硫酸 | B. |  汽油 | C. |  KNO3 | D. |  乙醇 |
 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示. .
. .
. .
.