题目内容
12.甲醇和乙醇是重要的化工原料,也是清洁的能源.(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:
反应①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)△H1
反应②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)△H2>0
反应③:C2H5OH(g)?CH3CHO(g)+H2(g)△H3>0
①分析增大压强对制备乙醇的影响增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大.
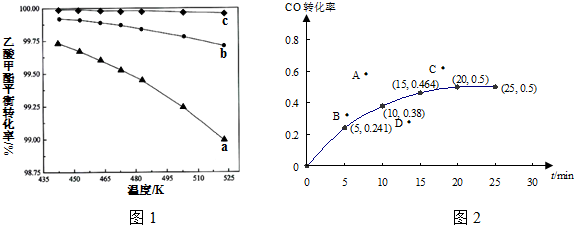
②反应①乙酸甲酯的平衡转化率与温度和氢碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)的关系如图1.
该反应的平衡常数K随温度升高变小.(填“变大”“不变”或“变小”);氢碳比最大的是曲线c.
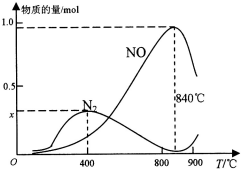
(2)①利用反应CO(g)+2H2(g)?CH3OH(g)合成甲醇.某温度下,向容积为2L的密闭容器中加入1mol CO和2mol H2,CO转化率的变化如图2所示,该温度下的平衡常数为4(保留两位有效数字,下同),若起始压强为12.6MPa,则10min时容器的压强为9.4 MPa.
②若保持其它条件不变,起始时加入2mol CO和2mol H2,再次达到平衡,相应的点是B.
(3)氢气可用CH4制备:CH4(g)+H2O(1)?CO(g)+3H2(g)△H=+250.1kJ•mol-1.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJ•mol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,已知该电池的能量转换效率为86.4%,则该电池的比能量为$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$kW•h•kg-1(只列计算式,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×106J).
分析 (1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向气体计量数减小,
反应②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,反应③:C2H5OH(g)?CH3CHO(g)+H2(g)正向气体计量数增加;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应;乙酸甲酯的转化率越小,则氢碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;压强之比等于物质的量之比;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小;
(3)根据盖斯定律解题;设燃料为1kg计算.
解答 解:(1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向气体计量数减小,所以平衡正向移动,
反应②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)?CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大,所以最大的是c,故答案为:变小; c;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.25}{0.25×0.{5}^{2}}$=4.0,$\frac{12.6}{3}=\frac{P}{3-0.38×2}$,所以P=9.4 MPa,故答案为:4.0;9.4 MPa;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为$\frac{1000}{16}$×890.3KJ×86.4%=4.8×107J;比能量为$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$.
点评 本题综合考查化学平衡的影响因素、CH4燃烧热的热化学方程式书写、比能量的应用,主要考查盖斯定律的应用,题目难度不大.

| A. | “胃得乐”(主要成分为碳酸镁)是一种抗酸药) | |
| B. | 鸦片、吗啡、海洛因等这些物质属于毒品 | |
| C. | 青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡 | |
| D. | “阿司匹林”是一种重要的抗生素 |
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
| A. |  如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. |  如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. | 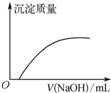 如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 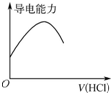 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 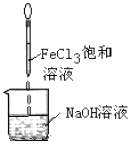 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
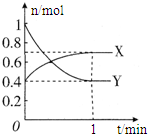 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: