题目内容
工业上利用铜制硫酸铜的主要反应为:2Cu+O2+2H2SO4
2CuSO4+2H2O.该反应中,被氧化的物质是 (填化学式),作为氧化剂的物质是 (填化学式);若反应中消耗了1mol Cu,则生成 mol CuSO4.
| ||
考点:氧化还原反应
专题:
分析:反应中Cu元素化合价升高,被氧化,Cu为还原剂,O元素化合价降低,被还原,O2为氧化剂,结合元素化合价的变化解答该题.
解答:
解:反应中Cu元素化合价由0价升高到+2价,被氧化,Cu为还原剂,O元素化合价由0价降低到-2价,被还原,O2为氧化剂,若反应中消耗了1mol Cu,由质量守恒可知应生成1molCuSO4,
故答案为:Cu;O2;1.
故答案为:Cu;O2;1.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,明确Cu、O元素的化合价变化即可解答,题目难度中等.

练习册系列答案
相关题目
下列各实验现象能用同一原理解释的是( )
| A、从煤中提取煤焦油和从石油中提取煤油 |
| B、乙酸和乙醛都能与新制Cu(OH)2反应 |
| C、乙烯、乙醛都能与溴水反应 |
| D、葡萄糖和福尔马林都能发生银镜反应 |
下列说法错误的是( )
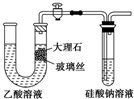

| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
已知O3能使淀粉碘化钾试纸变蓝,其反应式为2KI+O3+H2O═2KOH+I2+O2,对这一反应的叙述正确的是( )
| A、O2是还原产物 |
| B、O3分子中氧元素的化合价都降低了 |
| C、氧化产物与还原产物物质的量之比为1:2 |
| D、氧化产物与还原产物物质的量之比为1:1 |
氧化还原反应的实质是( )
| A、化合价的升降 |
| B、分子中各原子重新组合 |
| C、电子的得失或共用电子对的偏移 |
| D、氧原子的得失 |
A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量.若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是( )
| A、D2A |
| B、C2B |
| C、C2A |
| D、D2B |
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A、HClO的电子式 |
B、比例模型 :可以表示CH4,也可以表示CCl4 :可以表示CH4,也可以表示CCl4 |
| C、乙烯的结构简式:CH2CH2 |
| D、碳酸氢根电离:HCO3-+H2O?H3O++CO32- |