题目内容
5.1.00L 1.00mol•L-1硫酸与2.00L 1.00mol•L-1 NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热△H=-57.3kJ•mol-1,表示其中和热的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.分析 根据n=cV计算出氢离子、氢氧根离子的物质的量,再根据中和反应实质得出生成水的物质的量,然后计算出中和反应中生成1mol水放出热量,从而可知中和热的焓变;根据计算结果写出中和热的热化学方程式.
解答 解:1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,中和热△H=-$\frac{114.6kJ}{2mol}$=-57.3kJ/mol,
则中和热的热化学方程式:$\frac{1}{2}$ H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1,
故答案为:-57.3 kJ•mol-1;$\frac{1}{2}$ H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确中和热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.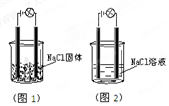 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
3.下列叙述正确的是( )
| A. | 由同种元素组成的物质一定是纯净物 | |
| B. | 科学家最近合成了一种新型的化合物N4 | |
| C. | 红磷转化为白磷是物理变化 | |
| D. | 纳米泡沫碳与金刚石是同素异形体 |
13.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
20.己知:60℃时,KNO3的溶解度为110g.在此温度下,向盛有l00mL水的烧杯中投入101g KNO3后充分搅拌,此烧杯中将会得到( )
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
14.下列属于有机物的是( )
| A. | HCl | B. | CO(NH2)2 | C. | CO2 | D. | H2O |
15.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 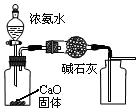 用图装置制取并收集干燥纯净的NH3 | |
| B. |  用图装置可以完成“喷泉”实验 | |
| C. | 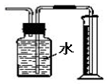 用图装置直接测量Cu与浓硝酸反应产生的NO2体积 | |
| D. | 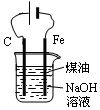 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).