题目内容
1.图是A-I九种物质之间的转化关系,其中部分生成物和反应条件已略去.已知A为非金属固态单质,C、E、F常温下都是无色气体.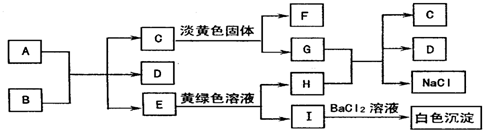
请填空:
(1)C的电子式是
 .
.(2)A与B反应的化学方程式是2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O.
(3)E转变为H和I的化学方程式是SO2+Cl2+2H2O=H2SO4+2HCl.
(4)C转变为F和G的化学方程式是2Na2O2+2CO2=2Na2CO3+O2↑.
分析 A为非金属固态单质,常温下C、E、F都是无色气体,且C与淡黄色固体反应得到F,E能与黄绿色溶液(应为氯水)反应,生成I与氯化钡反应有白色沉淀,则I中应含有硫酸根,A与B的反应是碳与浓酸硫的反应,故A为C,B为浓H2SO4,C为CO2,E为SO2,D为H2O,F为O2,G为Na2CO3,H为HCl,I为H2SO4.
解答 解:A为非金属固态单质,常温下C、E、F都是无色气体,且C与淡黄色固体反应得到F,E能与黄绿色溶液(应为氯水)反应,生成I与氯化钡反应有白色沉淀,则I中应含有硫酸根,A与B的反应是碳与浓酸硫的反应,故A为C,B为浓H2SO4,C为CO2,E为SO2,D为H2O,F为O2,G为Na2CO3,H为HCl,I为H2SO4.
(1)C为CO2,C的电子式是: ,故答案为:
,故答案为: ;
;
(2)A与B反应的化学方程式是:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O;
(3)E转变为H和I的化学方程式是:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)C转变为F和G的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑.
点评 本题考查无机物的推断,题目难度中等,物质的颜色及转化中特殊反应为推断的突破口,熟练掌握元素化合物知识.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
11.下列有机物分子中所有原子一定在同一平面内的是( )
| A. |  | B. |  | C. |  | D. |  |
9.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”.已知铱的一种同位素是19177Ir,则其核内的中子数与质子数之差是( )
| A. | 77 | B. | 37 | C. | 191 | D. | 114 |
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| B. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| C. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- |
6.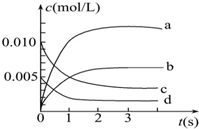 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.
(2)如图中表示NO2变化曲线的是b.用O2表示从0~2s内该反应的平均速率v=0.001 5 mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体密度保持不变.
 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示从0~2s内该反应的平均速率v=0.001 5 mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体密度保持不变.
10.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )
| A. | K3C60中只有离子键 | B. | K3C60中不含共价键 | ||
| C. | 该晶体在熔融状态下能导电 | D. | C60与12C互为同位素 |
 萨罗是一种消毒剂,它的分子式为C13H10O3,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等):
萨罗是一种消毒剂,它的分子式为C13H10O3,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等): .
.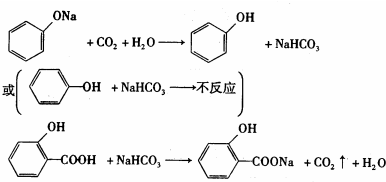
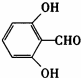 或
或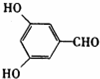 (任写一种).
(任写一种).
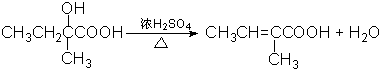 ⑥
⑥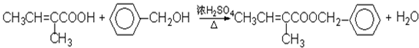
 .
.