题目内容
18.下列各式中,属于正确的电离方程式的是( )| A. | HCO3-+H+?H2CO3 | B. | HCO3-+OH-═H2O+CO32- | ||
| C. | NH3+H+═NH4+ | D. | NH3•H2O?NH4++OH- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.
A.表示碳酸氢根离子和氢离子生成碳酸的反应;
B.表示碳酸氢根离子和氢氧根离子的反应;
C.表示氨气和强酸的反应;
D.一水合氨为弱碱,部分电离出铵根离子和氢氧根离子.
解答 解:A.表示碳酸氢根离子和氢离子生成碳酸的反应,故A错误;
B.HCO3-+OH-=H2O+CO32-表示HCO3-与OH-反应的离子方程式,故B错误;
C.NH3+H+=NH4+表示NH3与H+反应的离子方程式,故C错误;
D.NH3•H2O?NH4++OH-表示NH3•H2O的电离方程式,故D正确;
故选D.
点评 本题考查电离方程式的书写,明确书写方法及弱电解质的电离书写是解答的关键,注意离子反应方程式和电离方程式的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | 丙烯 | B. | 对二甲苯 | C. |  | D. |  |
6.下列反应中不属于氧化还原反应是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | |
| B. | NH4Cl+NaOH═NH3•H2O+NaCl | |
| C. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ |
13.选取两个完全相同的密闭容器A、B,向A、B中都加入SO2和O2各l g,发生反应2SO2(g)+O2(g)?2SO3(g);△H<0.反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态.下列说法中,正确的是( )
| A. | 平衡时SO2的转化率:A>B | |
| B. | 可逆反应从开始到平衡放出的热量:A<B | |
| C. | 平衡时混合气体的总物质的量:A<B | |
| D. | 平衡时的化学反应速率:A>B |
3.将红磷和硫分别在如图所示的两个盛满O2的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )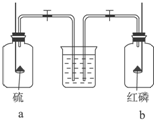

| A. | 水先进入a瓶 | B. | 水先进入b瓶 | ||
| C. | 水同时进入两瓶 | D. | 水不进入任何一瓶 |
10.关于溶液、浊液、胶体说法正确的是( )
| A. | 均能产生丁达尔现象 | B. | 都是混合物 | ||
| C. | 分散质均能透过半透膜 | D. | 分散质均能通过滤纸 |
7.实验室需用240mL 0.1mol•L-1的硫酸铜溶液,现选取250mL容量瓶进行配制,以下操作能配制成功的是( )
| A. | 称取3.84g CuSO4粉末,加入250mL水 | |
| B. | 称取6.25g CuSO4•5H2O晶体,加水配成250mL溶液 | |
| C. | 称取4.0g CuSO4粉末,加入250mL水 | |
| D. | 称取4.0g CuSO4•5H2O晶体,加水配成250mL溶液 |
8.X元素原子的最外层电子数与次外层电子数的差值等于电子层数;Y元素原子比X元素原子的最外层电子数多2.则X与Y所形成的化合物为( )
| A. | X3Y2 | B. | X2Y | C. | XY2 | D. | XY3 |
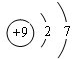 ,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.
,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.