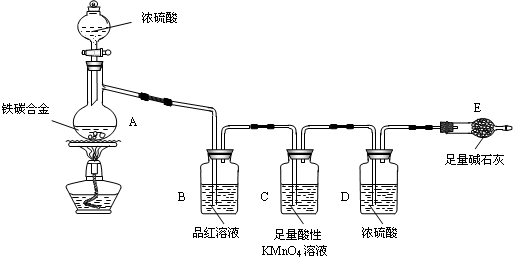
题目内容
3.将红磷和硫分别在如图所示的两个盛满O2的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )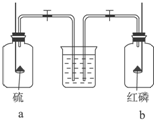
| A. | 水先进入a瓶 | B. | 水先进入b瓶 | ||
| C. | 水同时进入两瓶 | D. | 水不进入任何一瓶 |
分析 根据红磷和硫与氧气反应的生成物的状态进行分析,硫与氧气反应生成二氧化硫气体,红磷与氧气反应生成五氧化二磷固体.
解答 解:硫与O2反应生成的SO2是气体,反应前后气体的物质的量不变,装置内的压强不变;P与O2反应生成的P2O5是固体,反应后装置内的压强减小,水会先进入b瓶,
故选B.
点评 本题考查了无机物的性质,解答本题要注意燃烧后生成的物质对于压强的影响,分清压强的变化是正确解答本题的关键,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
14.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其是在寒冷的季节易诱发关节疼痛,其化学机理为:①HUr+H2O?$U{r^-}+{H_3}{O^+}$②Ur-(aq)+Na+(aq)?NaUr(s)
下列对反应②的叙述正确的是( )
下列对反应②的叙述正确的是( )
| A. | 反应的△H>0 | B. | 反应的△H<0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
11.下列说法正确的是( )
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等,PVC的单体可由PE的单体与氯化氢加成制得 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
18.下列各式中,属于正确的电离方程式的是( )
| A. | HCO3-+H+?H2CO3 | B. | HCO3-+OH-═H2O+CO32- | ||
| C. | NH3+H+═NH4+ | D. | NH3•H2O?NH4++OH- |
15. 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )| A. | 能与Br2发生加成反应 | B. | 能发生酯化反应 | ||
| C. | 能发生水解反应 | D. | 分子中有7个手性碳原子 |
13.元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
 .
.