题目内容
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越
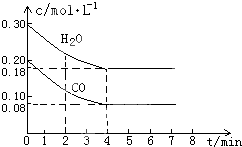
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0CO和H2O物质的量浓度变化如图所示,则:
①0-4min间平均反应速率v(CO)=
②在800℃时该反应的化学平衡常数K=
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20mol/L和0.80mol/L,则达到平衡时CO转化为CO2的转化率是:
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为:
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)依据平衡常数是表示平衡进行程度大小的量;化学反应吸热或放热反应,温度升高平衡向吸热反应方向进行;
(2)①根据υ=
计算反应速率;
②计算出平衡时各物质的浓度,再根据平衡常数的表达式计算;先计算出反应消耗的CO的浓度,再根据转化率公式计算;
③依据平衡常数不变,用化学平衡三段式列式计算;
(3)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
(2)①根据υ=
| △c |
| △t |
②计算出平衡时各物质的浓度,再根据平衡常数的表达式计算;先计算出反应消耗的CO的浓度,再根据转化率公式计算;
③依据平衡常数不变,用化学平衡三段式列式计算;
(3)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
解答:
解:(1)化学平衡常数K表示可逆反应的进行程度,依据平衡常数含义可知,K值越大,可逆反应的进行程度越大,转化率越大;温度升高,平衡向吸热反应方向进行,反应可能是吸热反应,也可能是放热反应,所以温度升高,平衡常数可能增大也可能减小;
故答案为:大;可能增大也可能减小;
(2)①υ(CO)=
=
=0.03mol/(L?min);
故答案为:0.03mol/(L?min);
②0~4min时,消耗的CO的浓度为:0.20mol/L-0.08mol/L=0.12mol/L,则CO的转化率为
×100%=60%;
用三段式法计算:
CO(g) 十 H2O(g) CO2(g) 十 H2 (g)
CO2(g) 十 H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=
=
=1,
故答案为:1;60%;
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为 0.20mol?L-1和0.80mol?L-1,设一氧化碳反应的浓度为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 0.20 0.80 0 0
变化量(mol/L) x x x x
平衡量(mol/L)0.20-x 0.80-x x x
K=
=1
x=0.16mol/L
则达到平衡时CO转化率=
×100%=80%;
故答案为:80%;
(3)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
故答案为:大;可能增大也可能减小;
(2)①υ(CO)=
| △c |
| △t |
| 0.2mol/L-0.08mol/L |
| 4min |
故答案为:0.03mol/(L?min);
②0~4min时,消耗的CO的浓度为:0.20mol/L-0.08mol/L=0.12mol/L,则CO的转化率为
| 0.12 |
| 0.20 |
用三段式法计算:
CO(g) 十 H2O(g)
 CO2(g) 十 H2 (g)
CO2(g) 十 H2 (g)起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
故答案为:1;60%;
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为 0.20mol?L-1和0.80mol?L-1,设一氧化碳反应的浓度为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 0.20 0.80 0 0
变化量(mol/L) x x x x
平衡量(mol/L)0.20-x 0.80-x x x
K=
| x2 |
| (0.20-x)(0.80-x) |
x=0.16mol/L
则达到平衡时CO转化率=
| 0.16mol/L |
| 0.20mol/L |
故答案为:80%;
(3)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
除去铁粉中少量的铝粉,可选用的试剂是( )
| A、氨水 | B、氢氧化钠溶液 |
| C、硫酸溶液 | D、盐酸 |
下列分子中所有原子都满足最外层8电子结构的是( )
①光气(COCl2) ②SF6 ③HCHO ④BF3 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
①光气(COCl2) ②SF6 ③HCHO ④BF3 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
| A、⑥⑦⑨ | B、①⑤⑨ |
| C、①④⑤⑦ | D、①④⑤⑨ |