题目内容
现有如下物质:①酒精、②铜、③氢氧化钡、④氨、⑤蔗糖、⑥高氯酸、⑦碳酸氢钠、
⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白
(1)属于强电解质的有: ;
(2)液态时能导电且为物理变化的有: ;
(3)将=10 ⑩的溶液蒸干后得到的固体是 ;(填化学式)
(4)⑦的电离方程式为 .
⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白
(1)属于强电解质的有:
(2)液态时能导电且为物理变化的有:
(3)将=10 ⑩的溶液蒸干后得到的固体是
(4)⑦的电离方程式为
考点:强电解质和弱电解质的概念,混合物和纯净物,电离方程式的书写,盐类水解的应用
专题:物质的分类专题,物质的性质和变化专题
分析:(1)强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物,一般包括强酸、强碱和大部分盐类;弱电解质是指:在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐;
(2)物理变化的本质是没有新物质的生成;
(3)硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸;
(4)碳酸氢钠属于盐在水中完全电离出钠离子与碳酸氢根离子,注意碳酸氢根为多元弱酸的酸式根离子不能拆.
(2)物理变化的本质是没有新物质的生成;
(3)硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸;
(4)碳酸氢钠属于盐在水中完全电离出钠离子与碳酸氢根离子,注意碳酸氢根为多元弱酸的酸式根离子不能拆.
解答:
解:(1)①酒精、④氨、⑤蔗糖在水溶液和熔融状态下都不导电,属于非电解质;
②铜是单质,既不是电解质又不是非电解质;
③氢氧化钡、⑥高氯酸、⑦碳酸氢钠、⑩Al2(SO4)3 在水溶液中能够完全电离,属于强电解质;
⑧磷酸、⑨硫化氢水溶液中只能部分电离,属于弱电解质;
故答案为:③⑥⑦⑩;
(2)②铜中含有自由移动的电子,导电时电子定向移动,没有新物质的生成,属于物理变化,故选:②;
(3)硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸,所以最终得到的产物是硫酸铝,故答案为;硫酸铝;
(4)碳酸氢钠属于盐在水中完全电离出钠离子与碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-.
②铜是单质,既不是电解质又不是非电解质;
③氢氧化钡、⑥高氯酸、⑦碳酸氢钠、⑩Al2(SO4)3 在水溶液中能够完全电离,属于强电解质;
⑧磷酸、⑨硫化氢水溶液中只能部分电离,属于弱电解质;
故答案为:③⑥⑦⑩;
(2)②铜中含有自由移动的电子,导电时电子定向移动,没有新物质的生成,属于物理变化,故选:②;
(3)硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸,所以最终得到的产物是硫酸铝,故答案为;硫酸铝;
(4)碳酸氢钠属于盐在水中完全电离出钠离子与碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-.
点评:本题考查了电解质及其强弱的判断,电离方程式的书写,盐类水解的应用,涉及知识点比较多,题目难度不大,注意强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号.

练习册系列答案
相关题目
关于晶体与化学键关系的下列说法中,正确的是( )
| A、离子晶体中一定存在共价键 |
| B、原子晶体中可能存在离子键 |
| C、金属晶体中存在离子,但却不存在离子键 |
| D、分子晶体中一定存在共价键 |
比较下列各组粒子半径,正确的是( )
①Cl<Cl-②Mg<Al③Na+<Na④Br<Cl.
①Cl<Cl-②Mg<Al③Na+<Na④Br<Cl.
| A、①和④ | B、只有② |
| C、只有③ | D、①和③ |
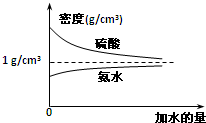 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: