题目内容
8.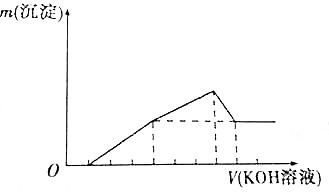 把镁铝合金用稀H2SO4溶解,加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量之比为( )
把镁铝合金用稀H2SO4溶解,加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量之比为( )| A. | 1:1 | B. | 8:9 | C. | 2:3 | D. | 4:3 |
分析 由图象可知,金属与酸反应时酸过量,利用7~8体积发生的反应为Al(OH)3+KOH═KAlO2+2H2O来计算Al的量,由1~7体积发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓来计算Mg的量,然后计算合金中镁和铝的质量比.
解答 解:设KOH的浓度为cmol/L,合金中Al的物质的量为x,Mg的物质的量为y,
由7~8体积发生的反应为Al(OH)3+KOH═KAlO2+2H2O,则
Al~Al(OH)3~NaOH
1 1
x (8-7)×0.001L×c
x=0.001cmol,
由1~7体积发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓,则
Al3++3OH-═Al(OH)3↓
1 3
0.001cmol 0.003cmol
Mg2++2OH-═Mg(OH)2↓
1 2
y (0.006c-0.003c)mol
y=0.0015cmol,
则合金中镁和铝的质量比为0.0015cmol×24g/mol:0.001cmol×27g/mol=4:3,
故选D.
点评 本题考查镁、铝及其化合物的性质,明确发生的化学反应及反应与图象的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
19.如图表示吸收能量反应的图象是( )
| A. |  | B. |  | C. |  | D. |  |
16.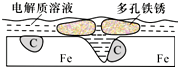 炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如右图所示,下列说法正确的是( )
炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如右图所示,下列说法正确的是( )
 炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如右图所示,下列说法正确的是( )
炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如右图所示,下列说法正确的是( )| A. | 腐蚀过程中,负极是C | |
| B. | Fe失去电子经电解质溶液转移给C | |
| C. | 正极的电极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 每生成1 mol铁锈(Fe2O3•xH2O)理论上消耗标准状况下的O233.6 L |
3.常温下,饱和NaClO溶液的pH约为11.某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl.下列解释相关事实的离子方程式中不合理的是( )
| A. | 该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-═HClO | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | 常温下,该消毒液的pH≈11,是因为:ClO-+H2O?HClO+OH- | |
| D. | 该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-═Cl2↑+H2O |
13.关于如图所示的原电池,下列说法正确的是( )


| A. | Zn为正极,Cu为负极 | B. | Cu片上发生氧化反应 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 正极反应为 2H++2e-═H2↑ |
20. 环上一溴代物的数目为(不考虑立体异构)( )
环上一溴代物的数目为(不考虑立体异构)( )
 环上一溴代物的数目为(不考虑立体异构)( )
环上一溴代物的数目为(不考虑立体异构)( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
20.关于CCl2F2(商品名称为氟利昂-12)的叙述正确的是( )
| A. | 有两种同分异构体 | B. | 是平面形分子 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
