题目内容
13.下列溶液中,溶质的物质的量浓度为0.1mol/L的是( )| A. | 将4gNaOH溶液溶入1L水中 | |
| B. | 常温下,将2.24LHCl气体溶于水配成1L溶液 | |
| C. | 含有4.9gH2SO4的溶液500mL | |
| D. | 将6.2gNa2O溶于水配成1L溶液 |
分析 A.计算氢氧化钠物质的量n=$\frac{m}{M}$,溶质浓度c=$\frac{n}{V}$;
B.标准状况下气体摩尔体积为22.4L/mol;
C.计算硫酸物质的量n=$\frac{m}{M}$,溶质浓度c=$\frac{n}{V}$;
D.计算氧化钠物质的量n=$\frac{m}{M}$,氧化钠和水反应生成氢氧化钠来计算溶质浓度c=$\frac{n}{V}$.
解答 解:A.将4gNaOH溶液溶入1L水中,溶质氢氧化钠物质的量n=$\frac{4g}{40g/mol}$=0.1mol,溶入1L水中溶液体积不是1L,故A错误;
B.常温下,2.24LHCl气体物质的量不是0.1mol,故B错误;
C.4.9gH2SO4的物质的量n=$\frac{4.9g}{98g/mol}$=0.05mol,溶液体积500mL,溶质浓度c=$\frac{0.05mol}{0.5L}$=0.1mol/L,故C正确;
D.6.2gNa2O物质的量n=$\frac{6.2g}{62g/mol}$=0.1mol,溶于水配成1L溶液,溶质氢氧化钠浓度c=$\frac{0.2mol}{1L}$=0.2mol/L,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析,主要是气体摩尔体积、物质的量和微粒数的计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
1.在浓度均为1mol•L-1的(NH4)2SO4和NH4Cl两种溶液中,NH4+的水解程度分别为a1,a2,NH4+的浓度分别为c1,c2,则( )
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
18.下列对氯及其化合物的说法正确的是( )
| A. | 少量的铁在氯气中燃烧生成FeCl3,过量的铁在氯气中燃烧生成FeCl2 | |
| B. | 用pH试纸可测得氯水的pH值 | |
| C. | 溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色 | |
| D. | 由Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,可推出Ca(ClO)2+SO2+H2O═CaCO3↓+2HClO |
2.下列说法不正确的是( )
| A. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
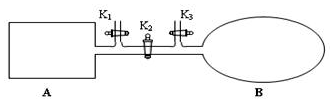 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L. .
. .
.
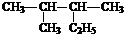 2,3-二甲基戊烷
2,3-二甲基戊烷