题目内容
20.X、Y为短周期元素,X位于第IA族,Y的最高正价与最低负价代数和为2,下列说法正确的( )| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
分析 X、Y为短周期元素X位于第IA族,则X可能为H或Li或Na;Y的最高正价与最低负价的代数和为2,则Y为N元素或P元素,结合元素化合物的性质分析.
解答 解:X、Y为短周期元素X位于第IA族,则X可能为H或Li或Na元素;Y的最高正价与最低负价的代数和为2,则Y为N元素或P元素,
A.若Y为N元素,其氧化物NO,不能和水反应,故A错误;
B.X可能为H或Li或Na元素,Y为N元素或P元素,二者形成的化合物,如氨气属于共价化合物,氮化钠属于离子化合物,故B正确;
C.若X为H元素,Y为N元素,则X的原子半径小于Y的原子半径,故C错误;
D.若X为Na元素,Y为N元素,则二者的简单离子具有相同的电子层结构,故D错误.
故选B.
点评 本题考查原子结构和元素周期律的关系,涉及元素化合物的性质、离子化合物与共价化合物、原子半径大小比较等知识点,正确判断元素是解本题关键,注意元素周期律的灵活运用,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
10.向含有1molFeCl2的溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使X2O72-还原为Xn+,则n值为( )
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
11.下列离子晶体晶格能比较正确的是( )
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>NaCl>KCl | D. | CaO>BaO>KCl>NaCl |
15.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向Ge(OH)4中加入盐酸:OH-+H+═H2O | |
| B. | MnO2 与浓盐酸反应制Cl2:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
12.下列离子方程式中,书写正确的是( )
| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 氯化钙溶液与碳酸钠溶液反应:Ca2++CO32-═CaCO3↓ | |
| C. | 硫酸溶液与碳酸钡反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2CO3 |
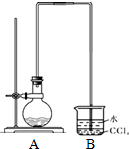 溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性):
溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性): .
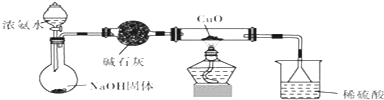
.
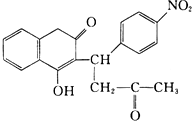
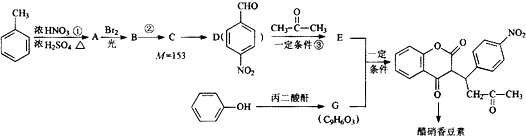
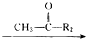 R1-CH═
R1-CH═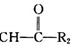 +H2O
+H2O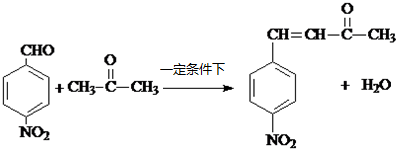 .
. .
.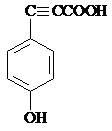 .
.