题目内容
11.下列离子晶体晶格能比较正确的是( )| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>NaCl>KCl | D. | CaO>BaO>KCl>NaCl |
分析 晶格能主要影响因素是离子电荷,电荷越高,晶格能越大;其次就是离子半径,离子半径越小,晶格能越大.
解答 解:BaO、CaO阴离子相同,电荷数相同,阳离子的半径越小,晶格能越大,阳离子半径:Ca2+>Ba2+,因此晶格能:CaO>BaO;
KCl、NaCl阴离子相同,电荷数相同,阳离子的半径越小,晶格能越大,阳离子半径K+>Na+,因此晶格能:NaCl>KCl,
阴、阳离子所带电荷越多,晶格能越大,而且电荷的影响大于半径的影响,
所以四种化合物晶格能的高低顺序为:CaO>BaO>NaCl>KCl,
故选C.
点评 本题考查晶格能的大小比较,题目难度中等,掌握晶格能的影响因素是解题的关键,注意主要、其次、再次的影响因素的影响大小.

练习册系列答案
相关题目
1.湖北荆门某化工厂违规快递有毒化学品,因泄漏导致9人中毒,1人死亡.涉事有毒化学品名为氟乙酸甲酯(F-CH2COOCH3),其具有-COO-结构的同分异构体还有(不考虑-O-F结构及立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
6.下面常见晶体的叙述中,错误的是( )
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
16.有机物丁香油酚结构简式为: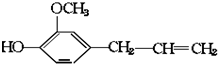 其可能具有的性质是( )
其可能具有的性质是( )
①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
 其可能具有的性质是( )
其可能具有的性质是( )①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
3.总质量一定的两种气态烃组成的混合物,无论以何种体积比混合,完全燃烧生成CO2的质量都一定,则此两种烃一定满足( )
| A. | 互为同分异构体 | B. | 最简式相同 | ||
| C. | 互为为同系物 | D. | 每个烃分子含相同数目的碳原子 |
20.X、Y为短周期元素,X位于第IA族,Y的最高正价与最低负价代数和为2,下列说法正确的( )
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
1.下列反应条件的控制中不恰当的是( )
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快H2O2的分解速率,把反应容器放到冷水中冷却 | |
| D. | 为加快KClO3的分解速率,加入MnO2 |
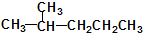 ②
②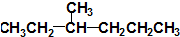 ③
③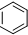
 ⑥
⑥