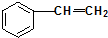题目内容
10.向含有1molFeCl2的溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使X2O72-还原为Xn+,则n值为( )| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
分析 1mol的FeCl2 完全被氧化成铁离子失去1mol电子,X2O72-中X的化合价为+6,根据氧化还原反应中得失电子相等计算出X的化合价及n的数值.
解答 解:0.2mol Cl2完全反应变成氯离子得到电子的物质的量为0.2mol×2=0.4mol;
Xn+的化合价为+n,X2O72-中X的化合价为+6,0.1mol X2O72-则完全反应得到电子的物质的量为(6-n)×2×0.1mol=0.2(6-n)mol;
1mol的FeCl2完全被氧化成铁离子失去1mol电子,
由电子守恒可得:0.4mol+0.2(6-n)mol=1mol,
解得n=3,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
20.PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂--甲胺铅碘的原料.合成PbI2的实验流程如图1:
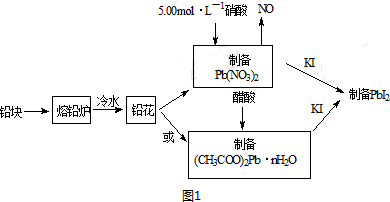
(1)将铅块制成铅花的目的是增大与酸的接触面积,加快溶解反应速率.
(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸80mL.
(3)取一定质量(CH3COO)2Pb•nH2O样品在N2气氛中加热,测得样品固体残留率)($\frac{固体样品的剩余质量}{固体样品的起始质量}$×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水).
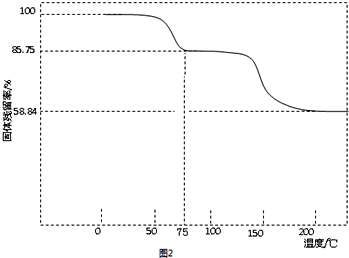
①(CH3COO)2Pb•nH2O中结晶水数目n=3(填整数).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为C4H6O3(写分子式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)═R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500mol•L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.则室温时PbI2 的Ksp为4.000×10-9.
(5)探究浓度对碘化铅沉淀溶解平衡的影响.
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响.
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3 饱和溶液、PbI2饱和溶液、PbI2悬浊液.
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子.
请填写下表的空白处:

(1)将铅块制成铅花的目的是增大与酸的接触面积,加快溶解反应速率.
(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸80mL.
(3)取一定质量(CH3COO)2Pb•nH2O样品在N2气氛中加热,测得样品固体残留率)($\frac{固体样品的剩余质量}{固体样品的起始质量}$×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水).

①(CH3COO)2Pb•nH2O中结晶水数目n=3(填整数).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为C4H6O3(写分子式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)═R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500mol•L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.则室温时PbI2 的Ksp为4.000×10-9.
(5)探究浓度对碘化铅沉淀溶解平衡的影响.
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响.
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3 饱和溶液、PbI2饱和溶液、PbI2悬浊液.
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子.
请填写下表的空白处:
| 实验内容 | 实验方法 | 实验现象及原因分析 |
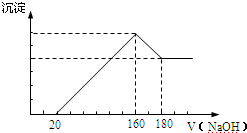
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式:PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
1.湖北荆门某化工厂违规快递有毒化学品,因泄漏导致9人中毒,1人死亡.涉事有毒化学品名为氟乙酸甲酯(F-CH2COOCH3),其具有-COO-结构的同分异构体还有(不考虑-O-F结构及立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
18.下列有关电解质溶液的说法正确的是( )
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
5.下列溶液中的离子可以大量共存且无色透明的是( )
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
20.X、Y为短周期元素,X位于第IA族,Y的最高正价与最低负价代数和为2,下列说法正确的( )
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
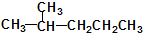 ②
②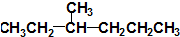 ③
③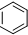
 ⑥
⑥