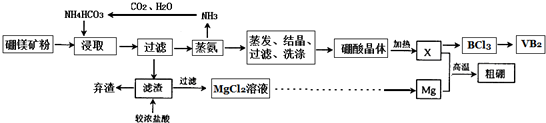
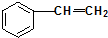题目内容
12.下列离子方程式中,书写正确的是( )| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 氯化钙溶液与碳酸钠溶液反应:Ca2++CO32-═CaCO3↓ | |
| C. | 硫酸溶液与碳酸钡反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2CO3 |
分析 A.氢氧化铜为沉淀,应保留化学式;
B.二者反应生成碳酸钙和氯化钠;
C.碳酸钡为沉淀,应保留化学式;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.氢氧化铜与盐酸反应:2H++Cu(OH)2═H2O+Cu2+,故A错误;
B.氯化钙溶液与碳酸钠溶液反应,离子方程式:Ca2++CO32-═CaCO3↓,故B正确;
C.硫酸溶液与碳酸钡反应,离子方程式:BaCO3+SO42-═BaSO4↓+H2O+CO2↑,故C错误;
D.碳酸钙与稀盐酸反应,离子方程式:CaCO3+2H+═H2O+Ca2++CO2↑,故D错误;
故选:B.
点评 本题考查了离子方程式书写,明确离子方程式书写注意事项是解题关键,注意化学式拆分,题目难度不大.

练习册系列答案
相关题目
3.总质量一定的两种气态烃组成的混合物,无论以何种体积比混合,完全燃烧生成CO2的质量都一定,则此两种烃一定满足( )
| A. | 互为同分异构体 | B. | 最简式相同 | ||
| C. | 互为为同系物 | D. | 每个烃分子含相同数目的碳原子 |
20.X、Y为短周期元素,X位于第IA族,Y的最高正价与最低负价代数和为2,下列说法正确的( )
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
7.有A、B、C、D、E、F六种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.F的单质可与酸反应,1mol F单质与足量酸反应能产生33.6L H2(标准状况);F的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)C在周期表中的位置为第三周期第ⅥA族.
(2)元素D的+1价含氧酸的电子式为 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| E | A | |||
| B | C | D |
(2)元素D的+1价含氧酸的电子式为
 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
17.下列关于SO2的叙述,正确的是( )
| A. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| B. | SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
4. 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:
某研究性学习小组对电解食盐水进行了如下探究:
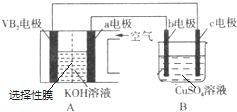
实验Ⅰ装置如图1所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图2所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
实验Ⅰ装置如图1所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图2所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
1.下列反应条件的控制中不恰当的是( )
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快H2O2的分解速率,把反应容器放到冷水中冷却 | |
| D. | 为加快KClO3的分解速率,加入MnO2 |
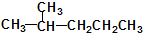 ②
②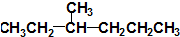 ③
③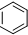
 ⑥
⑥