题目内容
4.下列判断不正确的是( )| A. | 酸性:HF>HCl>H2S | B. | 沸点:CBr4>CCl4>CF4 | ||
| C. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | D. | 稳定性:H2O>H2S>H2Se |
分析 A.HF为弱酸,HCl为强酸;
B.均为分子晶体,相对分子质量越大沸点越高;
C.金属性越强,对应碱的碱性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.酸性为HCl>HF>H2S,故A错误;
B.均为分子晶体,相对分子质量越大沸点越高,则沸点为CBr4>CCl4>CF4,故B正确;
C.金属性越强,对应碱的碱性越强,则碱性为Ca(OH)2>Mg(OH)2>Al(OH)3,故C正确;
D.非金属性越强,对应氢化物越稳定,则稳定性为H2O>H2S>H2Se,故D正确;
故选A.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 最外层电子数等于或大于3(小于8)的元素一定是主族元素 | |
| B. | 元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱 | |
| C. | 在主族元素中,最高正化合价均等于主族序数 | |
| D. | 元素的原子得电子越多,非金属性越强;失电子越多,金属性越强 |
19.下列各组物质一定互为同系物的是( )
①CH3CH2OH和CH3CH2CHO
②HCOOCH3和CH3COOCH2CH3
③CH3CH2O和HOCH2CH2OH
④CH4和C18H38
⑤C2H4和C6H12
⑥CH3OH和CH3OCH3.
①CH3CH2OH和CH3CH2CHO
②HCOOCH3和CH3COOCH2CH3
③CH3CH2O和HOCH2CH2OH
④CH4和C18H38
⑤C2H4和C6H12
⑥CH3OH和CH3OCH3.
| A. | ②③④⑤⑥ | B. | ③⑤ | C. | ②④ | D. | ②④⑤ |
9.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图: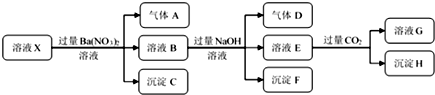
下列有关推断合理的是( )

下列有关推断合理的是( )
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
16.下列叙述中正确的是( )
| A. | 在元素周期表中,零族元素的单质在常温下全部都是气体 | |
| B. | 同周期元素,ⅦA族的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等 |
13.在相同体积的K2SO4溶液、CuSO4溶液Al2(SO4)3溶液中,分别加入足量的BaCl2溶液,产生相同质量的沉淀,则上述三种溶液的物质的量浓度之比是( )
| A. | 6:3:2 | B. | 3:3:1 | C. | 1:2:3 | D. | 1:1:3 |
14.下列反应不是可逆反应的是( )
| A. | CO2+H2O=H2CO3和H2CO3=CO2+H2O | |
| B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑和2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3和2SO3$\frac{\underline{催化剂}}{△}$2SO2+O2 | |
| D. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI和2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 |