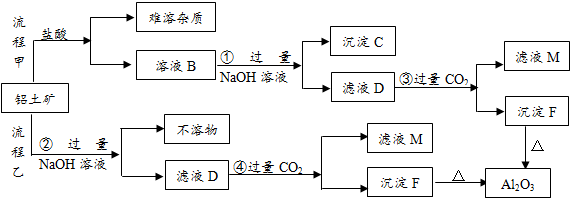
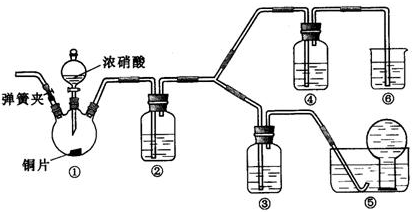
题目内容
4.写出乙烯与2一丁烯按1:1比例在一定条件发生加聚反应的化学方程式.分析 CH3CH=CHCH3与CH2=CH2发生加聚反应生成高分子,产物只有一种,以此来解答.
解答 解:CH3CH=CHCH3与CH2=CH2发生加聚反应生成高分子,化学反应为 ,
,
答:化学反应为 .
.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于学生的分析能力、应用能力的考查,把握加聚反应的特点为解答该类题目的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14. 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);试解释其原因同周期随原子序数增大第一电离能呈增大趋势,N元素2p轨道容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到下的顺序为N>O>C.
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为: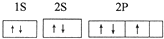
该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为:

该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
15.氯气溶于水达到平衡后,若只改变某一条件,下列叙述正确的是( )
| A. | 通入少量SO2,溶液漂白性增强 | |
| B. | 加入少量NaHCO3固体,c(ClO)减小 | |
| C. | 加入少量水,水的电离平衡向正方向移动 | |
| D. | 加入NaOH固体至恰好完全反应,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
19.下列实验中,所选用的装置、药品及对应原理都正确的是( )
| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
20.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和 Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为( )
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |

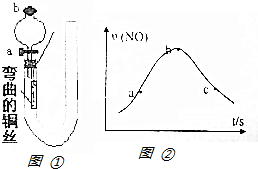 如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:
如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题: