题目内容
19.下列实验中,所选用的装置、药品及对应原理都正确的是( )| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙酸乙酯和乙醇互溶;
B.实验室用加热氯化铵晶体和消石灰固体的混合物制取氨气;
C.硝酸易挥发;
D.需要加热缺少酒精灯.
解答 解:A.乙酸乙酯和乙醇互溶,不分层,故A错误;
B.实验室用加热氯化铵晶体和消石灰固体的混合物制取氨气:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,故B正确;
C.硝酸易挥发,应除掉硝酸后,再通入硅酸,故C错误;
D.蒸馏需要加热缺少酒精灯,故D错误.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.能正确表示下列反应的离子方程式为( )
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
10.如图所示下列分析错误的是( )


| A. | 只闭合K2,该装置将电能转化为化学能 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐升高 | |
| C. | 只闭合K2,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | 铁腐蚀的速度由大到小的顺序是:只闭合K1>都断开>只闭合K2 |
11.下列液体混合物中可以用分液漏斗进行分离的是( )
| A. | 氯乙烷和水 | B. | 乙醇与水 | C. | 乙酸乙酯和乙醇 | D. | 漠苯与苯 |
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.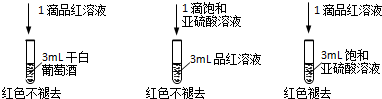
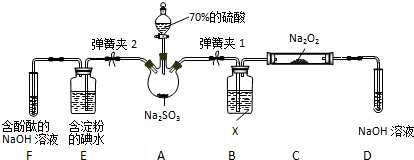
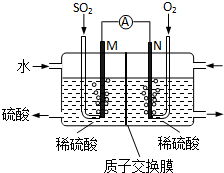



 ;
; ;
;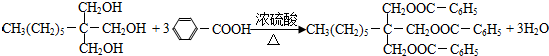 .
.