题目内容
19.浓硝酸、稀硝酸都具有强氧化性,某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器的装置已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.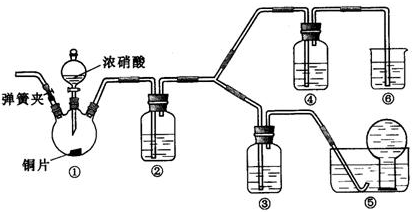
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应
2NO2+2NaOH═NaNO3+NaNO2+H2O
(1)浓硝酸与NO反应的氧化产物与还原产物的物质的量之比为1:2
(2)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
(3)滴加浓硝酸之前的操作依次是检验装置的气密性,加入药品,打开弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(4)装置①中发生反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,装置②的作用是将NO2转化为NO,发生反应的化学方程式是3NO2+H2O═2HNO3+NO
(5)该小组得出的结论所依据的实验现象是装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个试验来判断两种看法是否正确.这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化.
分析 (1)HNO3作氧化剂转化的NO2是还原产物,NO作还原剂转化的NO2是氧化产物,根据化合价升高和降低的价数相等计算;
(2)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸;
(3)由于装置中残存的空气能氧化NO而对实验产生干扰,需要先通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出;
(4)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,装置②中盛放H2O,使NO2与H2O反应生成NO;
(5)根据液面上方是否有红棕色NO2产生判断;
(6)根据是否改变溶液中硝酸铜的质量分数或溶解气体的浓度判断.
解答 解:(1)HNO3作氧化剂转化的NO2是还原产物,NO作还原剂转化的NO2是氧化产物,根据化合价升高和降低的价数相等,则2n(氧化产物)=n(还原产物),所以氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(2)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,装置④中盛放浓硫酸,
故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(3)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,
故答案为:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(4)装置①中Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,装置②中盛放H2O,使NO2与H2O反应生成NO,反应方程式为:3NO2+H2O═2HNO3+NO,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;将NO2转化为NO;3NO2+H2O═2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之,装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,
故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,可设计将溶解的NO2赶走(a、c方案)再观察颜色变化;也可在Cu(NO3)2的浓溶液中通入NO2进行比较观察反应后的颜色变化(d方案),确定是否是因为溶有NO2引起的;方案b由于Cu(NO3)2和溶解在其中的NO2浓度均可发生变化,故无法确定是哪一种因素引起的,故acd正确,
故答案为:acd.
点评 本题考查物质性质探究实验设计,利用对比的方法判断硝酸的性质,题目难度中等,是对基础知识与学生综合能力的考查,理解原理与各装置作用是解题的关键.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 硫磺 | B. | 苯酚 | C. | 硼酸 | D. | 甲醛 |
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将三份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如表所示:
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为35.2mL.(保留1位小数)
(2)甲实验结束后,溶液中c(NO3-)=2.75mol/L.
(3)混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
(4)乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
(5)计算丙实验中产生气体的体积(V).(写出计算过程)
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
 如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法.
如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法. ;I中所含化学键类型离子键、共价键.
;I中所含化学键类型离子键、共价键.