题目内容
7.下述实验方案能达到实验目的是( )| 选项 | A | B | C | D |
| 实验方案 |  |  |  | 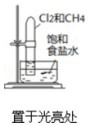 |
| 实验目的 | 验证铁钉发生了析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.食盐水为中性,发生吸氧腐蚀;
B.Fe与电源正极相连,为阳极,失去电子;
C.发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
D.发生取代反应生成HCl,HCl极易溶于水,试管中液面上升.
解答 解:A.食盐水为中性,发生吸氧腐蚀,酸性条件下发生析氢腐蚀,故A错误;
B.Fe与电源正极相连,为阳极,失去电子,则加快Fe的腐蚀,故B错误;
C.发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,不能检验乙烯的生成,故C错误;
D.发生取代反应生成HCl,HCl极易溶于水,试管中液面上升,则可验证甲烷与氯气发生了化学反应,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握电化学、有机物的性质、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
8.下列叙述中,正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 所有的糖类、油脂和蛋白质都能发生水解反应 | |
| D. | 符合分子式C5H12的物质有4种 |
18.为除去CO2气体中混有的少量SO2气体杂质,可以采用的方法是( )
| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
15.标况下,将一装满NO2气体的试管倒置在水槽中,可见试管中液面逐渐上升,反应结束后,试管中所得溶液的物质的量浓度为(忽略溶质的扩散)( )
| A. | 1 mol/L | B. | 22.4 mol/L | C. | 0.045 mol/L | D. | 0.03 mol/L |
2.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 氢氧化铜可溶于氨水说明氢氧化铜是两性氢氧化物 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
12.下列两种试剂不能做喷泉实验的是( )
| A. | NO2 水 | B. | CO2 4 mol•L-1NaOH溶液 | ||
| C. | Cl2 饱和NaCl溶液 | D. | NH3 1 mol•L-1盐酸 |
19.导致下列现象的主要原因与排放SO2有关的是( )
| A. | 温室效应 | B. | 酸雨 | C. | 臭氧空洞 | D. | 光化学烟雾 |
16.下列关于配合物的说法不正确的是( )
| A. | 硫酸铜的水溶液中,铜离子实际上主要以四水合铜离子的形式存在 | |
| B. | 氯化银沉淀能溶于氨水,说明有的配合物(或配离子)很稳定 | |
| C. | 金属离子都能作为中心离子,含有孤对电子的分子(或离子)都可作配体 | |
| D. | 硫氰合铁(III)离子呈血红色,由此可用KSCN溶液检验Fe3+离子 |
17.利用l00mL lmol/L稀硫酸与足量的锌粒反应制取氢气时,下列措施不能加快反应速率的是( )
| A. | 滴入少量硫酸铜溶液 | B. | 加入适量2mol/L稀硫酸 | ||
| C. | 适当加热 | D. | 改用200mL lmol/L稀硫酸 |