题目内容
16.下列关于配合物的说法不正确的是( )| A. | 硫酸铜的水溶液中,铜离子实际上主要以四水合铜离子的形式存在 | |
| B. | 氯化银沉淀能溶于氨水,说明有的配合物(或配离子)很稳定 | |
| C. | 金属离子都能作为中心离子,含有孤对电子的分子(或离子)都可作配体 | |
| D. | 硫氰合铁(III)离子呈血红色,由此可用KSCN溶液检验Fe3+离子 |
分析 A.硫酸铜的水溶液中,铜离子与水结合生成四水合铜离子;
B.氯化银沉淀能溶于氨水生成二氨合银离子;
C.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
D.根据KSCN溶液与Fe3+离子反应生成硫氰合铁离子判断.
解答 解:A.硫酸铜的水溶液中,铜离子与水结合生成四水合铜离子,所以在水溶液中,铜离子实际上主要以四水合铜离子的形式存在,故A正确;
B.氯化银沉淀能溶于氨水生成二氨合银离子,说明有的配合物(或配离子)很稳定,故B正确;
C.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键,而并不是所有金属离子都有空轨道,所以金属离子不是都能作为中心离子,故C错误;
D.KSCN溶液与Fe3+离子反应生成血红色的硫氰合铁离子,所以可用KSCN溶液检验Fe3+离子,故D正确;
故选C.
点评 本题考查了配合物的性质、配位键的形成等,难度不大,要明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.

练习册系列答案
相关题目
6.某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)下列说法正确的是( )
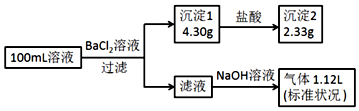

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
11.化学与生活、医疗、生产密切相关.下列物质的俗名与化学式相对应的是( )
| A. | 胆矾--FeSO4•7H2O | B. | 钡餐--BaCO3 | ||
| C. | 明矾--KAl(SO4)2 | D. | 生石膏--CaSO4•2H2O |
8.下列分散系中.分散质粒+直径最小的是( )
| A. | KC1 溶液 | B. | Fe (OH)3胶体 | C. | 牛奶 | D. | 石灰乳 |
6.常温下,分别将四块形状相同,质量均为7g的铁块同时投入下列四种溶液中,铁块首先溶解完的是( )
| A. | 20.0 mL 18 mol•L-1 H2SO4溶液 | B. | 250.0 mL 2 mol•L-1 HCl溶液 | ||
| C. | 150.0 mL 2 mol•L-1 H2SO4溶液 | D. | 500.0 mL 3 mol•L-1 HCl溶液 |




 ,C
,C .
. ; 反应⑦:
; 反应⑦: .
. 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示: