题目内容
15.标况下,将一装满NO2气体的试管倒置在水槽中,可见试管中液面逐渐上升,反应结束后,试管中所得溶液的物质的量浓度为(忽略溶质的扩散)( )| A. | 1 mol/L | B. | 22.4 mol/L | C. | 0.045 mol/L | D. | 0.03 mol/L |
分析 设试管的体积为VL,依据二氧化氮的体积计算其物质的量,依据反应:3NO2+H2O═2HNO3+NO,计算生成硝酸的物质的量及判断溶液体积,依据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:试管的体积为VL,则二氧化氮物质的量为:$\frac{V}{22.4}$mol,依据3NO2+H2O═2HNO3+NO可知生成硝酸的物质的量为:$\frac{V}{22.4}$×$\frac{2}{3}$(mol),溶液体积为$\frac{2}{3}$V,则溶液的物质的量浓度为:$\frac{\frac{V}{22,4}×\frac{2}{3}}{\frac{2V}{3}}$=$\frac{1}{22.4}$=0.045( mol/L)
故选:C.
点评 本题考查了物质的量浓度有关计算,明确物质的量浓度计算公式,熟悉二氧化氮性质是解题关键,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
16.反应2A(g)?2B(s)+C(g)△H>0,要使逆反应速率降低,应采取的措施是( )
| A. | 减压 | B. | 升温 | ||
| C. | 加压 | D. | 从体系中分离出一部分B物质 |
6.某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)下列说法正确的是( )
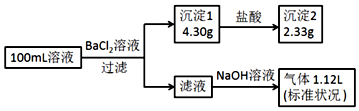

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
3.某气态烃1mol能与2mol HBr完全加成,加成后产物分子上的氢原子又可被4mol Cl2完全取代,则此气态烃可能是( )
| A. | CH≡CH | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH2=C(CH3)2 |
20.下列分子或离子中,中心原子含有孤对电子的是( )
| A. | SO2 | B. | CH4 | C. | CO2 | D. | NH4+ |





 ,C
,C .
. ; 反应⑦:
; 反应⑦: .
.