题目内容
6.元素性质呈现周期性变化的根本原因是( )| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
分析 随原子序数的递增,原子的结构呈现周期性的变化而引起元素的性质的周期性变化,以此来解答.
解答 解:元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化,最外层电子数决定元素的性质,元素的化合价为元素的性质,而电子层数、核电荷数不具有周期性变化,
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握结构与性质的关系为解答的关键,侧重分析与应用能力的考查,注意周期性变化的判断,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
17.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
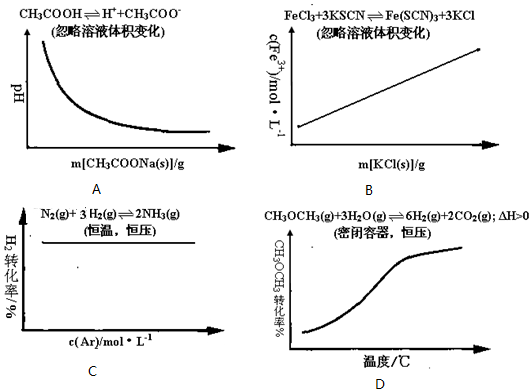

| A. | 向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图 | |
| B. | 向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图 | |
| C. | 密闭容器中进行N2(g)+3H2(g)?2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图 | |
| D. | 密闭容器中进行CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图 |
1.化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )


| A. | 化合物与氧化物属于交叉关系 | B. | 单质与非电解质属于包含关系 | ||
| C. | 溶液与分散系属于并列关系 | D. | 化合物与电解质属于包含关系 |
11.下列离子反应方程式正确的是( )
| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
18.对外加电流的金属保护中,被保护的金属( )
| A. | 与电源的正极相连 | B. | 表面上发生氧化反应 | ||
| C. | 与电源的负极相连 | D. | 与另一种活泼性较差的金属相连 |
15.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 工业上可角电解法制备Mg:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+C12↑ | |
| B. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| C. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | |
| D. | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
1.常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |