题目内容
17.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )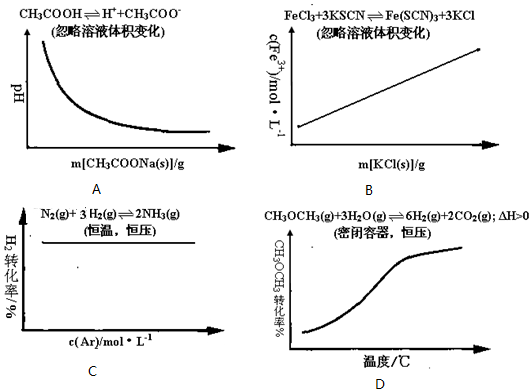
| A. | 向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图 | |
| B. | 向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图 | |
| C. | 密闭容器中进行N2(g)+3H2(g)?2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图 | |
| D. | 密闭容器中进行CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图 |
分析 A、醋酸溶液中逐渐加入醋酸钠晶体,同离子效应,抑制醋酸的电离,溶液的PH值变大;
B、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
C、保持恒温恒压条件下,逐渐通入稀有气体Ar,体积变大,相当于减小压强,平衡逆向移动;
D、升高温度向吸热反应方向移动.
解答 解:A、醋酸溶液中逐渐加入醋酸钠晶体,同离子效应,抑制醋酸的电离,溶液的PH值变大,而不是减小,故A错误;
B、根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,故B错误;
C、保持恒温恒压条件下,逐渐通入稀有气体Ar,体积变大,相当于减小压强,平衡逆向移动,所以H2的转化率减小,而不是不变,故C错误;
D、升高温度向吸热反应方向移动,所以保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变大,所以图象符合,故D正确;
故选D.
点评 本题考查化学平衡的影响因素分析判断,注意建立平衡的微粒分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
5.在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L-1,在一定条件下发生反应:A(g)+B(g)?2C(g).该温度下,此反应的平衡常数为4,则A的转化率为( )
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
12.摩尔是表示( )
| A. | 物质的量的单位 | B. | 物质的质量的单位 | ||
| C. | 物质的量的浓度 | D. | 摩尔质量的单位 |
2.向某密闭容器中加入0.3molA、0.1molC 和一定量的 B 三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段 c ( B)未画出].附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
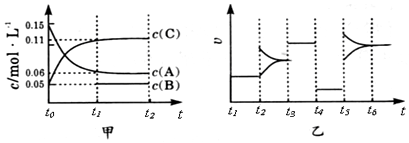

| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
9.对于一定不能自发进行的反应来说,反应后体系的( )
| A. | 混乱度增大,而能量降低 | B. | 混乱度降低,而能量增大 | ||
| C. | 混乱度降低,而能量降低 | D. | 混乱度增大,而能量增大 |
6.元素性质呈现周期性变化的根本原因是( )
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
7.把200mL含有BaCl2和KCl溶液的混合溶液分成两等份,取一份加入含amol Na2SO4的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子的浓度为( )
| A. | 0.5(b-2a)mol/L | B. | 5(b-2a)mol/L | C. | 0.5(b-a)mol/L | D. | 10(b-2a)mol/L |