题目内容
11.下列离子反应方程式正确的是( )| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
分析 A.氢氧化铁为难溶物,离子方程式中不能拆开;
B.氨水为弱碱,离子方程式中一水合氨不能拆开;
C.氧化铁不能拆开,需要保留化学式;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:A.Fe(OH)3 溶于稀 H2SO4中,氢氧化铁不能拆开,正确的离子方程式为:3H++Fe(OH)3=Fe3++3H2O,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeO溶于稀HCl中,FeO不能拆开,正确的离子方程式为:FeO+2H+=Fe2++H2O,故C错误;
D.铝溶解在 NaOH 溶液中,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
1.反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
①反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
2.向某密闭容器中加入0.3molA、0.1molC 和一定量的 B 三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段 c ( B)未画出].附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
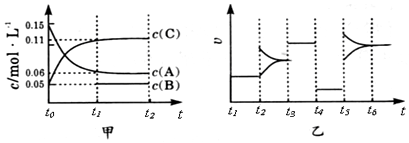

| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
19.在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2?2NH3.在一定温度下达到平衡,H2的转化率为20%.若在同一容器中充入NH3,欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是( )
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
6.元素性质呈现周期性变化的根本原因是( )
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
3.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
20.关于下列各装置图的叙述中,正确的是( )
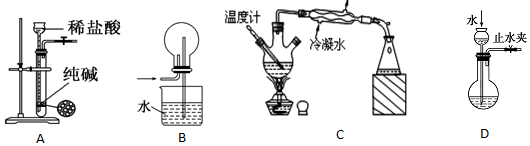

| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
6.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O(l)?CuSO4•xH2O(s),当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
 )的官能团的名称为碳碳双键、羟基.
)的官能团的名称为碳碳双键、羟基.