题目内容
13.下列实验方案正确的是( )| A. | 苯甲酸的提纯:将1g粗苯甲酸放到100mL的烧杯里,加入50mL水,加热完全溶解后趁 热过滤,静置冷却可析出苯甲酸晶体 | |
| B. | 除去苯中的苯酚杂质:向混有苯酚的苯中加入浓溴水,产生白色沉淀,再过滤 | |
| C. | 证明溴乙烷中溴元素的存在:向溴乙烷中加入NaOH溶液,共热,冷却后加入AgNO3溶液,产生浅黄色沉淀 | |
| D. | 银氨溶液的配制:向1mL 2%的稀氨水中逐滴滴加2%的AgNO3溶液 |
分析 A.温度高时苯甲酸的溶解度大,可减少苯甲酸的损耗;
B.苯酚与溴反应生成三溴苯酚,三溴苯酚与苯混溶;
C.检验溴离子时,在加入硝酸银溶液前应该先加硝酸酸化;
D.银氨溶液的配制时,应该在硝酸银溶液中滴加氨水至沉淀恰好消失.
解答 解:A.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要趁热过滤,可减少苯甲酸的损耗,该操作方法合理,故A正确;
B.苯酚与溴反应生成三溴苯酚,三溴苯酚与苯混溶,且易溶解溴,不能通过过滤分离,应用氢氧化钠溶液除杂,故B错误;
C.溴乙烷与NaOH溶液混合共热,发生水解反应生成溴离子,检验溴离子先加硝酸酸化,再滴加AgNO3溶液,生成浅黄色沉淀可证明,故C错误;
D.氨水和硝酸银反应生成AgOH,在硝酸银溶液中滴加氨水至沉淀恰好消失可配制银氨溶液,该操作方法不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液的配制、离子检验以及物质的分离提纯等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
15.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 48gO3和O2的混合气体中有NA个分子 | |
| B. | 常温常压下,4.6g的NO2气体含有0.3NA个原子 | |
| C. | 1L 0.5mol/L的CuCl2中含有0.5NA个Cu2+ | |
| D. | 标准状况下,3.36L H2O中含有1.5NA个水分子 |
4.下列微粒的核外电子排布式书写违反泡利原理的是( )
| A. | C:1s22s22p2 | B. | Na+:1s22s22p43s2 | ||
| C. | S2-:1s22s22p23s23p4 | D. | K:1s22s22p63s23p7 |
8.在氧化还原反应中,水既不作氧化剂又不作还原剂的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+H2O═HCl+HClO |
18.在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 | |
| B. | v正(CO2)=3v逆(H2) | |
| C. | 容器内混合气体平均相对分子质量保持不变 | |
| D. | 容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等 |
5.用0.2mol/L Na2SO3溶液32mL,还原含2×10-3 mol X2O72-的溶液,过量的Na2SO3用0.1mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6mL,则元素X在还原产物中的化合价是( )
| A. | +3 | B. | +4 | C. | +5 | D. | 0 |
2.如图装置可以组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
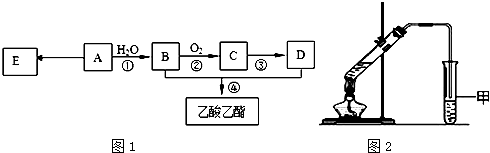
 .
.
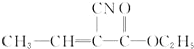 ,写出各步反应的化学方程式
,写出各步反应的化学方程式 .
.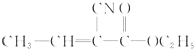 被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式
被涂在手术伤口表面,在数秒内发生固化(加聚)并起黏结作用以代替缝合,是一种性能优良的功能高分子材料,写出该化合物固化时的化学反应方程式 .
.