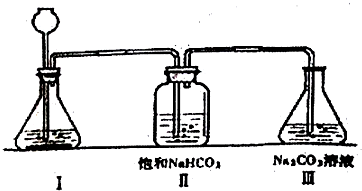
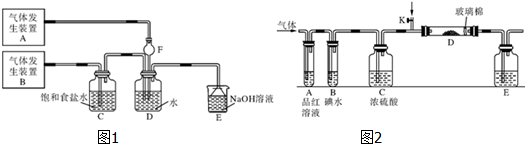
题目内容
18.下列实验操作均要用到玻璃棒,其中作用相同的是( )①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①④ |
分析 玻璃棒在很多操作中被用到,不同操作中玻璃棒的作用也不相同,如引流、搅拌加速溶解、防止液体飞溅、转移固体等作用.
在过滤操作中的作用是引流;
在蒸发操作和配制溶液中是搅拌;
蒸发完毕可以用玻璃棒转移固体;
玻璃棒还能起的作用是蘸取少许溶液测pH;
红磷燃烧试验中引燃红磷;
在溶解固体时是用玻璃棒来加速溶解,在过滤中用玻璃棒是引导液体的流向,防止外流,以此解答该题.
解答 解:①过滤时用玻璃棒引流;②蒸发时用玻璃棒搅拌,防止局部过热;③溶解时用玻璃棒搅拌,可加速固体的溶解;④向容量瓶中转移液体,可用玻璃棒引流,
则玻璃棒作用相同的是①和④或②和③,
故选D.
点评 本题主要考查了玻璃棒的作用,熟悉各实验中玻璃棒的作用及使用注意事项即可解答,学习中注意相关基础知识的积累,题目较简单.

练习册系列答案
相关题目
7.下列是某学生自己总结的一些规律,其中正确的是( )
| A. | 所有元素都有同位素 | |
| B. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| C. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| D. | 氧化物只可能是氧化产物,不可能是还原产物 |
8.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ca2+、HCO3-、NO3-、K+ |
13.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的电子数为9NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 46 g NO2和N2O4的混合物含有的氮原子数为1NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
10.某agNaOH固体在空气中放置一段时间后变质,含Na2CO3 4.24%,含H2O3.6%,将此化合物与100mL 1mol/L硫酸完全反应,剩余的硫酸恰好被20mL b mol/L的NaOH溶液完全中和,将所得溶液蒸干,固体质量约为( )
| A. | 1.65ab | B. | 14.2g | C. | 14.2bg | D. | 无法确定 |
7.近日,科学研究发现液态水或存在第二形态,当水被加热到40℃~60℃之间时,它的导热性、折射率、导电性等属性也会发生改变.下列说法正确的是( )
| A. | 氢氧两种元素只能组成H2O | |
| B. | 导热性等属于水的化学性质 | |
| C. | 0℃时冰的密度比液态水的密度小 | |
| D. | 液态水两种形态间转化需断裂O-H键 |
8.钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X.下列说法错误的是( )
| A. | 反应中PdCl2作氧化剂,被还原 | B. | 每转移2 mol e-时,生成1 mol X | ||
| C. | 未知物质X为CO2,属于还原产物 | D. | 还原性:CO>Pd |