题目内容
13.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )| A. | 1 mol NH3所含有的电子数为9NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 46 g NO2和N2O4的混合物含有的氮原子数为1NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
分析 A.氨气分子中含有10个电子;
B.标准状况下气体摩尔体积为22.4L/mol;
C.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含氮原子数;
D.溶液体积不知不能计算微粒数.
解答 解:A.氨气分子中含有10个电子,1 mol NH3所含有的电子数为10NA,故A错误;
B.常温常压下,22.4 L氧气物质的量不是1mol,故B错误;
C.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含氮原子数=$\frac{46g}{46g/mol}$×1×NA=NA,故C正确;
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,溶液体积不知不能计算微粒数,不能计算含有Cl- 个数,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析判断和计算应用,掌握物质的量和足量、气体体积、微粒数等物理量的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.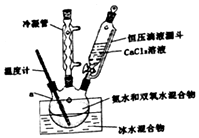 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:
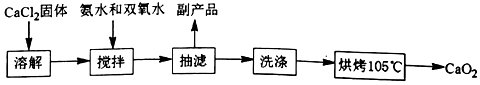
(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
已知:
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:

(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
1.在实验室制取下列气体时,作反应容器的试管口及用排空气法收集气体的集气瓶口都必须向上的是( )
| A. | 用高锰酸钾制取氧气 | |
| B. | 用氯酸钾和二氧化锰制取氧气 | |
| C. | 用锌和稀硫酸制取氢气 | |
| D. | 用石灰石和稀盐酸制取二氧化碳气体 |
8.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
18.下列实验操作均要用到玻璃棒,其中作用相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体.
①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①④ |
5.下列叙述正确的是( )
| A. | 某溶液中加入硝酸银溶液时,生成白色沉淀,说明溶液中有Cl- | |
| B. | 某溶液中加入稀硫酸溶液时,生成无色气体,说明溶液中有CO32- | |
| C. | 某溶液中加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- | |
| D. | 某溶液中加入盐酸溶液,无明显现象,再加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- |
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol NaHCO3晶体中含有NA个CO32- | |
| B. | 标准状况下,11.2L的18O2中所含的中子数为8NA | |
| C. | 1mol Fe与足量的稀HNO3反应,转移电子数目为3NA | |
| D. | 标准状况下,22.4L苯中含有碳氢键数目为6NA |
