题目内容
7.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )| A. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | B. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C. | c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | D. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
分析 根据溶解度判断沉淀的先后顺序,溶解度小的先生成沉淀,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小.
解答 解:若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,
反应后剩余n(Ag+)=0.006L×0.01mol/L=6×10-5mol,继续生成AgCl沉淀,
反应后剩余n(Cl-)=0.01×0.01mol/L-6×10-5mol=4×10-5mol,
c(Cl-)=$\frac{4×1{0}^{-5}mol}{0.026L}$=1.53×10-3mol/L,浊液中c(Ag+)═$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{(1.25×1{0}^{-5})^{2}}{1.53×1{0}^{-3}}$=1.02×10-7mol/L,
c(I-)═$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{(1.22×1{0}^{-8})^{2}}{1.02×1{0}^{-7}}$=1.48×10-9mol/L,
混合溶液中n(K+)=2×10-4mol,
n(NO3-)=0.016L×0.01mol/L=1.6×10-4mol,则c(K+)>c(NO3-),
故c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故选:B.
点评 本题考查难溶电解制得溶解平衡及溶液中离子浓度大小比较,本题注意溶液中各物质的量计算出剩余c(Cl-),再根据Ksp计算银离子浓度和碘离子浓度,题目难度中等.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA | |
| B. | 6.4gCu与过量硫粉反应,转移电子数为0.2NA | |
| C. | 通常状况下,112mL水中含有的电子数约为62.2NA | |
| D. | 标况下,2.24LSO3中含有0.1NA个SO3分子 |
15.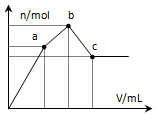 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
2.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
12.分子式为C10H14 的有机物有多种,其中苯环上的二元取代物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
16.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
17.如表是周期表中的一部分,根据A-I在周期表中的位置,第(1)-(4)小题用元素符号或化学式回答,(5)-(6)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)A、B、E、F、G、H中,原子半径顺序是Na>P>Cl>N>F>H
(5)工业上制备C的原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4A1+3O2↑
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)A、B、E、F、G、H中,原子半径顺序是Na>P>Cl>N>F>H
(5)工业上制备C的原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4A1+3O2↑
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
