题目内容
2.下列各化合物的命名正确的是( )| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
分析 A.该有机物为丁二烯,不是二丁烯;
B.该有机物为乙酸与乙二醇发生酯化反应生成的酯;
C.羟基在2号C,羟基的编号错误;
D.该有机物为烷烃,主链为丁烷,甲基在2号C.
解答 解:A.CH2=CH-CH=CH2为二烯烃,分子中含有4个C,碳碳双键在1、3号C,其名称为:1,3-丁二烯,故A错误;
B.CH3COOCH2CH2OOCCH3为二乙酸乙二酯,不是乙二酸二乙酯,故B错误;
C.CH3CH2CH(OH)CH3中羟基在2号C,正确名称为2-丁醇,故C错误;
D. 的最长碳链含有4个C,主链为丁烷,在2号C含有1个甲基,其名称为:2-甲基丁烷,故D正确;
的最长碳链含有4个C,主链为丁烷,在2号C含有1个甲基,其名称为:2-甲基丁烷,故D正确;
故选D.
点评 本题考查了有机物命名,题目难度不大,明确常见有机物的命名原则为解答关键,A为易错点,注意二丁烯和丁二烯的区别,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
12.下列反应的离子方程式正确的是( )
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
13.下列有关有机物的说法正确的是( )
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
10.下列叙述中,正确的是( )
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 最高价含氧酸一定具有强氧化性 | |
| D. | 金属阳离子被还原一定得到金属单质 |
7.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | B. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C. | c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | D. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
14. 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.032mol•L-1•min-1,T1℃时,该反应的平衡常数K=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
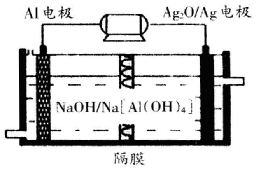
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=2(不考虑溶液体积的变化).
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=2(不考虑溶液体积的变化).


 ,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.
,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.